שאלון: Quiz
מולקולרית 2 שאלה 16
מה צפוי להתרחש בתא מנזק של פירימידין דימר, הנגרם על ידי קרינת UV?
נושא השאלה: DNA repair.
תשובה: א’. הפירמידינים (Pyrimidines) בדנ”א הם ציטוזין וטימין. כאשר מתרחשת בהם מוטציה שיוצרת דימר ביניהם (לא משנה באיזו קומבינציה – T-T, T-C או C-C) הרפליקציה תעצר, כך שללנו את סעיף ד) ויופעל מנגנון ה-NER שיביא להסרת מקטע חד-גדילי קצר המכיל את הדימר (את המוטציה) ודנ”א פולימראז יגיע לסנתז את הרצף מחדש . חשוב לזכור שמנגנון ה-BER נזקים יחסית מינורים ומתקן בסיס ספציפי זאת ע”י אנזימים ייעודיים שמוציאים רק את הבסיס הפגום ושמים אחד תקין במקומו, מה ששולל את סעיפים ב’ ו-ג’, כאשר הנזק יותר מסובך (כגון יצירת קשר בין 2 בסיסים – דימר) התא משתמש ב-NER.
להרחבה- Alberts, מהדורה 7, עמ׳ 288-289
מולקולרית 2 שאלה 15
במנגנון MMR, מי מבצע חיתוך לגדיל החדש על מנת להוציאו באאוקריוטים?
במה השאלה עוסקת: במנגנון Mismatch Repair
תשובה ג’. באאוקריוטיים, ל- MutL יש יכולת לייצר ניקים בדנ”א בעצמו ובכך מסייע להסרת מקטע מהגדיל הפגום.
בפרוקריוטים צוין בעבר שיש את MutH שמבצע את הניקים לגדיל הפגום, מכאן שתשובה א אינה נכונה. MutH ירד מהסילבוס ב-2025, אך נשאר פה כמסיח מבלבל מתוך מחשבה שצריך לדעת לפתור שאלות גם מבלי להכיר את כלל הסעיפים. זה קורה הרבה במבחן.
צריך לזכור ש- MutS נקשר ישירות לזוג הבסיסים שאינו קומפלמנטרי (שלילת מסיח ב).
את אנדונוקלאז פגשנו במנגנוני תיקון אחרים (NER, NHEJ ורקומבינציה הומולוגית) אך לא במנגנון הנ”ל, לכן מסיח ד נפסל גם הוא.
להרחבה- Alberts, מהדורה 7, עמ׳ 267-268
מולקולרית 4 שאלה 17
מה מהבאים לא נכון בהקשר של אפקט וובל?
תשובה ב‘. זיווג בסיסים מסוג Wobble הוא מקרה שבו האנטי-קודון (Anti-codon arm) של ה-tRNA מסוגל “לסבול” או “לקבל” חוסר התאמה כאשר מבצע זיווג בסיסים עם הקודון של ה-mRNA, וזה רק בעמדה הכי 5′ באנטי-קודון (שהיא גם העמדה הכי 3′ של הקודון). חוסר התאמה (Mismatch) זה, מאפשר לסוגי tRNA שונים, אשר דומים ב-2 מתוך 3 הבסיסים של האנטי-קודון והקודון, להתחבר לאותו הקודון גם אם הם שונים ואינם מתאימים בעמדה אחת מתוך האנטי-קודון. אפקט זה לא יכול להתרחש בעמדה 1 או 2 של האנטי-קודון אשר יותר “מחמירים” עם הדרישות להתאמה בזיווגי הבסיסים ביניהם. כמו כן, תופעה זו קיימת הן באאוקריוטים והן בפרוקריוטים, ולכן מסיח זה אינו נכון. ההבדלים בזיווגי הוובל שבין האאוקריוטים והפרוקריוטים כפי שניתן לראות בתמונה, נובעים מהמבנה השונה של הריבוזום ביניהם.
שלילת מסיחים:
א’. אכן עמדת הוובל (Wobble position) נמצאת בעמדה שנמצאת הכי במורד הזרם (Downstream), כלומר בקצה הכי 3′ של הגדיל, בקודון. וכךלהיפך בנוגע לאנטי-קודון, עמדה זו נמצאת הכי Upstream.
ג’. עצם זה שזיווג הבסיסים שבין האנטי-קודון לבין הקודון נעשה בידי 2 בסיסים בלבד ולא כל הבסיסים בקודון, מאפשר ל-tRNA שונים שמתאימים רק ב-2 בסיסים להתחבר לקודון. כלומר, ניתן להשתמש בפחות סוגים של tRNA על מנת להשלים את תהליך התרגום.
ד’. הנוקלאוטיד אינוזין נוצר בריאקציה של דה-אמינציה (Deamination) של אדנין (Adenine). בסיס זה יחסית נפוץ ב-tRNA, וכפי שניתן לראות, עקב הדמיון שלו לגואנוזין (Guanosine) הוא מסוגל להתחבר כמעט לכל שאר הבסיסים מלבד הגואנוזין, ולכן משפט זה נכון.
להרחבה – Alberts, מהדורה שביעית, עמ’ 359-361 (Wobble).
מולקולרית 3 שאלה 1
איזה מהמשפטים הבאים נכון לגבי שעתוק ועיבוד RNA?
במה השאלה עוסקת: RNA polymerase.
תשובה ד . ישנם שלושה סוגי RNA polymerase באאוקריוטים – 1, 2 ו-3. כאשר בפרוקריוטים ישנו רנ”א פולימראז יחיד. הבדל בין סוגי הפולימראזות האאוקריוטיות הוא לא במבנה שלהם אלא בגנים שהם משעתקים. רנ”א פולימראז 2 משעתק את הגנים שמקודדים לחלבונים,snoRNA, miRNA, siRNA, lncRNA ורוב ה-snRNA (פירוט על שאר הפולימראזות בטבלה שבמקורות). רנ”א פולימראז 2 דורש פקטורי שעתוק כלליים (General transcription factors) ייחודיים לפעילותו, כגון TFIIA, TFIIB, TFIID וכדומה. פקטור אחד חשוב שנקרא TFIIH אשר פועל גם כהליקאז(Helicase) אחראי על זרחון (Phosphorylation) של זנב הרנ”א פולימראז 2 שנקרא CTD (C-terminal domain) . זנב ה-CTD הוא ייחודי רק לפולימראז 2 ומשמש כאתר למודיפיקציות רבות אשר משפיעות ישירות על פעילותו. כאשר TFIIH מזרחן את RNA pol II על סרין 5 (Ser5) בזנב ה-CTD, הפולימראז משתחרר מהפרומוטר (Promoter) ומאפשר את התחלת שלב האלונגציה(Elongation) בתהליך השעתוק.
שלילת מסיחים:
- ה-RNA polymerase I משעתק 3 סוגים של rRNA (ribosomalRNA) – 5.8S, 18S ו-28S, וכפי שזכור, יחד עם ה-5S שאותו משעתק -RNA polymerase III ועוד מספר חלבונים, יוצרים את הריבוזום . את כל החלבונים ללא יוצא מן הכללמ שעתק רנ”א פולימראז 2. ולכן תשובה זו אינה נכונה. חשוב לשים לב שרנ”א פולימראז משעתק גדיל אחד ארוך שנקרא 35S rRNA אשר עובר עיבודים ומודיפיקציות שונות ומפורק לשלוש תתי-היחידות הללו (5S, 5.8S ו-28S).
- כפי שהוזכר מעל, בחיידקים קיים רק RNA polymerase יחיד אשר מבצע את כל שעתוק הגנים בחיידק. פולימראז זה הוא הומולוג ל-RNA polymerase II האאוקריוטי במבנה שלו, אומנם ישנם מספר הבדלים ביניהם כגון מספר היחידות(12 תתי-יחידות בפולימראז האאוקריוטי לעומת 5 בפרוקריוטי), הפקטורים שעוזרים להתחיל את פעילותו (רנ”א פולימראז פוקריוטי דורש רק את פקטור האינציאציה (Initiation factor) סיגמא (σ) לעומת האאוקריוטי שדורש מספר רק של פקטורי שעתוק כלליים) וכן צורת האריזה של הדנ”א (האאוקריוטי צריך שהדנ”א יהיה דחוס בעזרת נוקלאוזומים על מנת לפעול).
- יצירת ה-5′ cap בקצה גדיל ה-RNA היא פעילות ייחודית לאאוקריוטים ולא קיימת בפרוקריוטים. ה-5′ cap הוא בעצם המודיפיקציה הראשונה שנעשית על גדיל הרנ”א ממש בהתחלת תהליך השעתוק (בערך ב-25 הנוקלאוטידים הראשונים ששועתקו) והוא מקנה הגנה מדגרדציה, משתתף בהוצאת הגדיל מהגרעין (תהליך ה-Export שלו) ובהתחלת התרגום. חשוב לשים לב, שמבנה זה קיים רק בmRNA, כלומר הוא נעשה רק ע״י-RNA polymerase II וגם כאן, הפעלת הרכבת ה-5′ cap דורשת פוספורילציה מיוחדת על זנב ה-CTD.
להרחבה – Alberts, מהדורה שביעית, ע”מ 325-326 (RNA polymerase), ע”מ 338-339 (5′ cap) וע”מ 365-367 (Ribosome).
מולקולרית 1 שאלה 12
משפחת הגנים המשותפת הגדולה ביותר, של גנים עתיקים משותפים, עוסקת במה?
התשובה הנכונה- ג׳. מסיבות שונות הקשורות לתהליך האבולוציה, קשה—ואולי אף בלתי אפשרי—לקבוע בוודאות מה היה מכלול הגנים הקדמוני שממנו צמחו מגוון צורות החיים הקיימות היום. עם זאת, ניתן לגבש אומדן גס באמצעות ספירת משפחות גנים המיוצגות במגוון מינים (גם אם לא בכולם) משלושת הדומיינים העיקריים של החיים.- ארכיאה, בקטריה ואאוקריוטים.
בניתוח אחד מסוג זה, נמצאו 264 משפחות גנים עתיקות ומשומרות, שלכל אחת מהן יוחס תפקיד על סמך הגן המוכר ביותר באותה משפחה. המספר הגדול ביותר של המשפחות הללו מעורב בתהליכי תרגום (translation), וכן במטבוליזם ובהובלה של חומצות אמינו. חשוב להדגיש שקבוצה זו של משפחות גנים משומרות מייצגת רק מתווה גס של הירושה המשותפת לכל צורות החיים המודרניות.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 21-22. טבלה 1-1
מולקולרית 1 שאלה 11
בתאים איאוקריוטים, לכל כרומוזום יש:
השאלה עוסקת: Origin of replication.
תשובה ג . מקור השכפול (Origin of Replication) הוא אזור בכרומוזום שממנו מתחיל תהליך השכפול, הן באאוקריוטים והן בפרוקריוטים. עקב ההבדל הגדול באורך הגנום בין אאוקריוטים לפרוקריוטים, לאאוקריוטים יש מספר רב של Ori לעומת הפרוקריוטים שמסתפקים ב-Ori יחיד. מעצם חשיבותו של אזור זה הוא מבוקר בצורה הדוקה מאוד ע”י מספר רב של חלבונים, אנזימים ופקטורים שונים.
הערת המחבר – מושג קריטי בהקשר מקור השכפול שחשוב להכיר הוא “Refractory period”. מושג זה מתאר את תקופת הזמן שבה ה-Ori מעוכב ואינו יכול לעבור הפעלה מחדש. עיכוב זה מאפשר מניעת הכפלה נוספת בזמן תהליך ההכפלה. רק כאשר תהליך ההכפלה מסתיים ה-Refractory period יגמר ויתאפשר תהליך נוסף של שכפול. בחיידקים, תהליך עיכוב זה מתאפשר ע”י עיכוב ה-Initiator protein שנקרא dnaA , אשר אינו מסוגל להתחיל לפעול כאשר רצף ה-GATC חצי ממותל (HemiMethylated). החלבון שמונע את פעילותו של dnaA נקרא SeqA, והוא התנתק מהדנ”א רק כאשר הדנ”א יעבור מתילציה מלאה ע”י האנזים DNA methylase (נקרא גם Dammethylase).
שלילת מסיחים:
א’. כפי שנאמר מעל, רק פרוקריוטים מאופיינים ב-Ori יחיד מכיוון שהגנום שלהם קצר יחסית. מקור שכפול זה מאופיין ברצף שעשיר ב-A-T אשר יפתח בעזרת חיבור מולקולות dnaA לאזור Upstream ייעודי ב-Ori. לאחר מכן, dnaC יטען את dnaB (הליקאז) על אזור ה-A-T . ולבסוף dnaG (פרימאז) יתחבר גם ל-Ori על מנת לאפשר ל-DNA polymerase להתחיל לסנתז.
ב’. שכפול מלא של כל הגנום של פרוקריוטים לוקח בממוצע כ-30 דקות (עם Ori יחיד), אם לאאוקריוטים היה רק מקור שכפול אחד תהליך השכפול היה אורך כ-35 ימים לכרומוזום. על מנת לקצר זמן לא סביר זה ישנם עשרות אלפים של מקורות שכפול המופעלים בו-זמנית. ולכן מסיח זה אינו נכון.
ד’. מקור שכפול יחיד, ספציפי וקבוע נראה רק בחיידקים. אומנם גם באאוקריוטים מקורות השכפול הם ספציפיים וקבועים אך הם רבים.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 273-277
מולקולרית 1 שאלה 20
איזה חלבון נקשר לרצף GGGTTA?
תשובה א. הטלומראז (Telomerase) הוא אנזים אאוקריוטי אשר אחראי על הארכת הטלומר בקצוות הכרומוזומים. לקראת סוף תהליך השכפול (Replication) הפרימאז (Primase) לא יכול עוד לשים פריימרים (Primers) בקצה 3′ (כי הגדיל קצר מידי) ולכן ללא פעולת הטלומראז הגדיל היה מתקצר במעט בכל הכפלה (מה שגורם בסופו של דבר לאיבוד מידע ול”הזדקנות” התא). הטלומראז הוא אנזים מסוג רוורס טרנסקריפטאז (Reverse transcriptase) אשר מסוגל לסנתז DNA על בסיס תבנית RNA (נקרא RNA dependent DNA polymerase). האנזים בנוי מחלק חלבוני ומגדיל RNA שיוצר את רצף הטלומר TTAGGG, לרצף זה מתחברים חלבונים מיוחדים שנקראים Shelterin אשר יוצרים בו את מבנה ה-T-loop ומגנים עליו.
שלילת מסיחים:
ב. החלבון DnaA הוא חלבון פרוקריוטי שמתחבר ל-Origin בשלב האינציאציה (Initiation) של השכפול ופורם את הגדילים באזור ה-AT rich על מנת לאפשר להליקאזות (Helicases) להתחבר ל- DNA.
ג החלבון- TBP, שמו המלא -TATA Binding Protein, הוא חלק בפקטור השעתוק הכללי (General transcription factor) שנקרא TFIID אשר מתחבר ל-TATA box ומאפשר את התחלת השעתוק באאוקריוטים. זהו אומנם גם חלבון שמתחבר ל-DNA אך במיקום שונה לגמרי ובתהליך שונה (שעתוק ולא שכפול), ולכן מסיח זה אינו נכון. נלמד עליו בהרחבה בשיעור מולקולרית 3.
ד. ה-Cdc6 הוא חלבון שקשור לשלב האינציאציה בהכפלת אאוקריוטים.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 282.
מולקולרית 4 שאלה 4
RNA סינטטי המכיל את הרצף הבא …AUAAUAAUAAU… והודגר אצל חיידקים. בהנחה ולא נדרש קודון התחלה לרצף, כמה פפטידים שונים יוכלו להיווצר ממנו?
תשובה ד‘. מסגרת הקריאה (Reading frame) היא רצף הנוקלאוטידים (Nucleotides) שב-mRNA שממנו יקודדו את החלבון. כזכור, מסגרת הקריאה בנויה מקודונים (Codons) שהם רצף של שלושה נוקלאוטידים צמודים שמהווים כ”קוד” לח. אמינו מסוימת. באופן גורף ניתן להגיד שלכל mRNA, יש שלוש מסגרות קריאה אפשריות, אך התלות בקודון ההתחלה היא זו שמכתיבה את מסגרת הקריאה הנכונה עבור ה-mRNA הנתון. בכללי, ניתן ליצור שלושה צירופים מכל רצף של mRNA. פירוט: (1) כאשר הקודון הראשון מתחיל מהנוקלאוטיד הראשון. (2) כאשר הקודון הראשון מתחיל מהנוקלאוטיד השני. ו-(3) כאשר הקודון מתחיל מהנוקלאוטיד השלישי (ראו איור בע”מ 334). בהקשר השאלה, מהרצף …AUAAUAAUAAU… ניתן ליצור שלושה מסגרות קריאה: (1) רצף של AUA-AUA-AUA (הקודון הראשון מתחיל מהנוקלאוטיד הראשון).(2) רצף של UAA-UAA-UAA (הקודון הראשון מתחיל מהנוקלאוטיד השני), ו-(3) AAU-AAU-AAU (הקודון הראשון מתחיל מהנוקלאוטיד השני). כאשר הרצף השני של הקודונים UAA מהווה כרצף של קודוני סיום (Stop codons) ולכן הרצף לא יקודד לפפטיד בכלל. ולכן נוכל לקבל רק כ-2 פפטידים מהרצף הנתון.
הערת המחבר – חשוב להכיר ולזכור בעל פה את שלושת קודוני הסיום – UAA, UAG ו-UGA (“או-אה”, “או-אג” ו-“עו-גה”).
להרחבה– Alberts, מהדורה שביעית, ע”מ 358-359 (Reading frame) וע”מ 374-375 (Stop codons).
מולקולרית 3 שאלה 3
איזה RNA Polymerase, אחראי על שעתוק rRNA בפרוקריוטים?
במה השאלה עוסקת: RNA polymerase.
תשובה ד‘. הקומפלקס רנ”א פולימראז (RNA polymerase) אחראי על תהליך השעתוק (Transcripation) כלומר על ייצור גדיל RNA מתבנית הDNA . כפי שידוע, ישנם סוגים שונים שלRNA כגון mRNA, tRNA, miRNA, snRNA, snoRNA, lncRNA וכדומה. כמו ב-DNA polymerase, גם כאן יש הבדלים בין האנזימים האאוקריוטים לפרוקריוטים. באאוקריוטים ישנם שלושה סוגים עיקריים של רנ”א פולימראז אשר ממוספרים מ-1 עד 3. כאשר רנ”א פולימראז 1 אחראי על שעתוק רוב ה-rRNA (18S, 5.8S ו-28S), רנ”א פולימראז 2 משעתק את ה-snoRNA (עיבוד רנ”א), miRNA, siRNA, lncRNA, רוב snRNA וכל ה-mRNA. רנ”א פולימראז 3 אחראי עלשעתוק tRNA, חלק מה-snRNA ועוד מספר מצומם של רנ”א קצרים. הפרדה זו היא לא מקרית וקיימת מכיוון שפעולת השעתוק מתרחשת במספר אזורים בגרעין, למשל שעתוק rRNA מתרחש בגרעינון(Nucleolus) ורק הרנ”א פולימראז 1 נמצא באזור זה ואחראי על שעתוק הגנים שם. בהמשך לכך, בפרוקריוטים ישנו רנ”א פולימראז יחיד אשר מסוגל לשעתק את כל סוגי ה-RNA, ולכן תשובה זו היא הנכונה.
שלילת מסיחים:
א. כפי שנאמר מעל, רנ”א פולימראז 1 הוא הפולימראז האאוקריוטי שאחראי על שעתוק ה-45S-rRNA בגרעינון אשר עובר עיבודים ומודיפיקציות שונות ע”י snoRNA רבים והופך ל-3 גדיליה-rRNA שיחד עם ה-5S (שמשועתק ע”י רנ”א פולימראז 3 מחוץ לגרעינוןמרכיבים את הריבוזום (Ribosome). ולכן מסיח זה אינו נכון.
ב. רנ”א פולימראז 2 הוא גם פולימראז אאוקריוטי אשר אינו משעתק כלל rRNA, ולכן מסיח זה אינו נכון. בהקשר הפולימראז הפרוקריוטי מצאו כי דווקא נר”א פולימראז 2 מהווה כהומולוג שלו, ויש להם הרבה מן המשותף במבנה שלהם. ההבדלים העיקריים ביניהם הם בפקטורי האינציאציה שלהם (פקטור סיגמא בפרוקריוטים ופקטורי שעתוק כלליים רבים באאוקריוטים), זנב ה-CTD (C-terminal domain) הייחודי באאוקריוטים וצורת הדחיסה של הדנ”א אשר הכרחית באאוקריוטים לתהליך השעתוק.
ג. רנ”א פולימראז 3 אחראי על שעתוק מולקולות רנ”א רבות באאוקריוטים, ולכן מסיח זה אינו נכון.
להרחבה – Alberts, מהדורה שביעית, ע”מ 331-332 (RNA polymerase).
מולקולרית 5 שאלה 6
אלמנט בקרתי שפועל רחוק מאזור המטרה שלו והאפקט הרגולטורי שלו מופעל באמצעות תוצר חלבוני מסיס הוא?
תשובה:
התשובה הנכונה היא ב’- פקטורי שעתוק מבקרים ביטוי גנים בתא, קובעים את ריכוז התוצר ותזמון ביטויו. הגנים לפקטורי שעתוק מפוזרים בגנום ומיקומם יכול להיות קרוב או רחוק מהגן שאותו הם מבקרים. במילים אחרות, מיקום הגן של פקטורי השעתוק, לא רלוונטי לשעתוק הגן שאותם פקטורים מבקרים. המסיח מתייחס לרצפים שמקודדים לפקטורי שעתוק, כלומר, תוצרי אותם רצפים שנמצאים רחוק או קרוב לגן המבוקר (אולי אפילו על כרומוזום אחר), הם פקטורי שעתוק. בעצם, אלו תוצרים חלבוניים, שמעצם היותם חלבונים בתא, מסוגלים לעבור דיפוזיה, והם אלו שמשפיעים על בקרת ביטוי הגנים, הם יוצרים את האפקט הרגולטורי.
שלילת מסיחים:
א. אנהנסר הוא רצף DNAשיכול להמצא רחוק מהגן אותו הוא מבקר. אנהנסרים קושרים אקטיבטורים שמעודדים שעתוק. אולם לאנהנסר אין תוצר חלבוני שמסוגל לעבור דיפוזיה. מאחר ואנהנסרים לא מקודדים לחלבונים כלל, אלא רק לוקחים חלק בבקרת ביטוי גנים על ידי קשירת אקטיבטור, פקטור חלבוני בקרתי.
ג. פרומוטור הוא הרצף שאליו נקשר RNA פולימראז ופקטורי השעתוק הכלליים. הפרומוטור קובע את נקודת תחילת השעתוק ונמצא סמוך מאוד לאזור המטרה שלו. כלומר, פרומוטור נמצא בצמוד לגן לשעתוק. בנוסף, בדומה לאנהנסר, הפרומוטור עצמו לא מקודד לתוצר חלבוני, אלא רק מהווה רצף בקרתי.
ד. אופרטור הוא רצף שקושר רפרסור ומעכב שעתוק של גן. בדומה להסברים למסיחים א’ וג’, אופרטור הוא רק רצף בקרתי ואינו מקודד לתוצר חלבוני. יש לשים לבכי הדגש בשאלה היא המילה “תוצר”, שקובע כי על הרצף לקודד לתוצר חלבוני בעל האפקט הבקרתי.
להרחבה – Alberts, מהדורה שביעית, עמ’ 410-412 (operator), עמ’ 328-329 (promoter)
מולקולרית 1 שאלה 13
קצה ה-‘3 של גדיל DNA הוא האזור במולקולה בו:
תשובה ג. ה-DNA, בנוי מ-2 חד-גדילים המחוברים ביניהם באמצעות Base pairing. כל חד-גדיל הוא המשלים לחד-גדיל שממלו, אך בכיווניות הפוכה. לכל אחד מהם יש קצה 3′ (3′ end) וקצה 5′ (5′ end) אשר נקראים כך מכיוון שבקצה אחד ישנו הידרוקסיל (Hydroxyl) על פחמן 3′ בבסיס החנקני האחרון ובקצה האחרישנו הידרוקסיל על פחמן 5′ בבסיסי החנקני, בהתאמה. מולקולות הידרוקסיל אלו יכולות ליצור קשרי פוספודיאסטר (Phosphodiester) עם בסיסים נוספים.
שלילת מסיחים:
א’. אכן שני הקצוות של ה-DNA הפוכים אחד לשני בקצה 3′, אך כפי שנאמר מעל, הכיווניות של החד-גדילים היא הפוכה לכל אורכו – ולא רק בקצה 3′. ולכן מסיח זה איננו נכון.
ב’. האנזים שבונה את הפריימרים (Primers) נקרא DNA primase, הוא בונה פריימרים בכיווניות של 5′ ל-3′ (כיווניות הזהה לכל סוגי הפולימרזות). ה-DNA primase אינו בונה את הפריימרים ספציפית בקצה 3′ של ה-DNA אלא לכל אורכו (בעיקר ב-Lagging strand, ומעט מאוד ב-Leading strand), ולכן מסיח זה אינו נכון.
ד’. מסיח זה מנסה לבלבל עם קצה 5′ של גדילי ה-RNA שבנוי משלושה נוקלאוטידים (Nucleotides) מסוג גואנין (Guanine). כזכור, במהלך תהליך השעתוק (Transcription) באאוקריוטים, ישנם 3 אנזימים שונים המתיישבים על זנב ה-CTD (C-terminal domain) של ה-RNA polymerase II ומתחילים לייצר את ה-5′ Cap. ולכן לא צריך נוקלאוטידים מקבילים בגדיל התבנית (Template strand) על מנת לייצרו.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 3-5
מולקולרית 2 שאלה 5
מבין הבאים מה היא הפגיעה אשר מתוקנת הכי הרבה פעמים בדנ״א?
במה השאלה עוסקת : תיקון נזקי דנ”א
תשובה ב’. דה-פורינציה (Depurination) הוא הנזק האנדוגני שעובר הכי הרבה תיקונים בדנ”א ליממה כ-18,000 פעמים בערך ב-24 שעות. מבנה הפורין מפורק מהאדנין או מגואנין, לרוב ע”י מולקולת מים גורם להשארת הבסיס הסוכרי (די-אוקסיריבוז) בגדיל ללא הבסיס החנקני שלו.
שלילת מסיחים:
א. תהליך תיקון ה-Depyrimidination מתרחש כ-600 פעם ביממה, הרבה יותר נמוך מתהליך הדה-פורינציה.
ג. תהליך תיקון הדה-אמינציה (deamination) של ציטוזין מתרחש כ-100 פעמים ביממה בערך.
ד. ה-8-oxo G הוא תהליך של נזק חמצוני אשר מתוקן כ-1500 פעמים ביממה.
להרחבה-Alberts, מהדורה 7, עמ’ 286
מולקולרית 1 שאלה 3
מה נכון לגבי משפחות גנים?
הסבר: תשובה ד׳.
משפחות גנים הן משפחות של גנים דומים/קשורים (related) באותו הגנום. לשלוש ממלכות העל – ארכיאה, בקטריה ואאוקריוטים, יש יותר מ200 משפחות גנים משותפות (שלילת מסיח ב׳). השאלה מתייחסת לטבלה והנתון בסעיף ד׳ מופיע שם- ישנן 63 משפחות גנים הקשורות בתרגום ומשותפות גם לבקטריה גם לארכיאה וגם לאאוקריוטים. יש רק 2 משפחות המשותפות לכולם וקשורות בחלוקה תאית ומחזור התא (שלילת מסיח ג׳). והמשפחה הנפוצה ביותר, כמו שכבר אמרנו – תרגום, שייכת לתחום של עיבוד מידע (כך מגדיר הספר) ולכן סעיף א׳ אינו נכון.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 20-22, ו – Table 1-1ֿ
מולקולרית 3 שאלה 4
את.ה מתעניינ.ת בדפוס ביטוי של גן מסוים, שנקרא גן X, ברקמות שונות באותו אורגניזם. את.ה מבודד.ת את הרנ״א מהרקמה, מריצ.ה אותו בג׳ל אגארוז, עושה Blot, וצובע.ת את הרנ״א עם גלאי רדיו אקטיבי שהוא קומפלימנטרי לאקסון 2 בגן X. לאחר ביצוע אוטורדיוגרפיה לתספיג, ניתן לזהות כי בכל פס ריצה בג׳ל יש band בגובה אחר, וישנם מס׳ פסי ריצה ללא בנדים. מה אפשר להסיק מהתוצאות?
במה השאלה עוסקת: Gel electrophoresis.
תשובה ב . בשאלה זו נעשה שימוש בשיטת אלקטרופורזה בג’ל (Gel electrophoresis) על מנת לבדוק נוכחות של מקטע RNA המטרה, שבמקרה זה הוא האקסון 2 שהוא חלק מהגן הנחקר (גן X). כאשר הריצו את ה-RNA בבאריות (בכל בארית גדיל RNA מרקמה שונה, אך מאותו האורגניזם) ונתקבל פס (band) שונה בכל בארית, ניתן להסיק כי גדיל ה-RNA נמצא ברקמה אך באורכים שונים (ואף לעיתים אינו נמצא). התהליך שעלול לגרום לתוצאה זו הוא תהליך השחבור החליפי (Alternative splicing) אשר גורם לתוצר RNA שונה מאותו הגן עקב שינוי האקסונים והאינטרונים של אותו הגדיל RNA. כלומר, כחלק מתהליך עיבוד ה-mRNA נחתכים ממנו אקסונים ועקב כך נוצר mRNA שונה שמתורגם לחלבון מעט שונה. תהליך זה מאפשר להגדיל את המגוון של התוצרים שניתן להפיק מגן יחיד. ולכן בהקשר השאלה תהליך זה יכול לגרום לתוצרי RNA שונים בכל רקמה מה שיראה כתוצרי RNA בגדלים שונים בכל בארית.
שלילת מסיחים:
א’. לא ניתן לדעת האם כל גן X מבוטא ברקמות מסוימות מכיוון שנבדק רק אקסון ספציפי בתוכו (אקסון 2), יכול להיות שגן X כן בא לידי ביטוי אך האקסון הפך לאינטרון בתהליך השחבור החלופי ולכן אינו מופיע כלל.
ג’. לא ניתן לדעת האם מתרחש שחבור חלופי ברקמה הנתונה מכיוון שהניסוי מראה רק האם האקסון בא לידי ביטוי ברקמות שונות. על מנת לדעת האם התעתיק הראשוני עובר שחבור חלופי צריך לדעת מהו השחבור המקורי שאותו עובר הגן ורק אז נוכל לדעת האם נעשים שחבורים חלופיים לאותו התעתיק. בבדיקה זו רואים רק שיש שוני בין הרקמות בהקשר התוצר, ולא באיזה מהם התרחש שחבור חלופי.
ד’. תהליך השחבור (Splicing) אינו משתנה בין רקמה לרקמה בהקשר של חלבון מסוים. כאשר התעתיק הראשוני יעבור שחבור שונה זה יקרא שחבור חלופי. ולכן מסיח זה אינו נכון.
להרחבה – Alberts, מהדורה שביעית, ע”מ 499-500 (Gel electrophoresis), ע”מ339-342 (Splicing), (Alternative splicing).
מולקולרית 2 שאלה 18
מה נכון לגבי DNA-only Transposons?
במה עוסקת השאלה- טרנספוזונים.
תשובה נכונה- ב׳. חלק מטרנספוזוני DNA-only, זזים במנגנון של ״העתק- הדבק״ וחלק זזים ממקום אחד בדנ״א, למקום אחר בדנ״א ע״י שכפול של עצמם. אלה הם טרנספוזוני DNA-only מסוג הליטרונים (שלילת מסיח א׳). הם נמצאים בכל היצורים החיים (שלילת מסיח ד׳), אך בעיקר בצמחים ובע״ח שם הם מהווים מס׳ אחוזים מהגנום שלהם, לכן תשובה ב׳ נכונה. חשוב להכיר שבגלל צורת המעבר שלהם ע״י רפליקציה של עצמם, הם מעבירים איתם מעט מדנ״א המארח ממקום למקום ולכן חושבים שיש להם תפקיד חשוב בערבוב מידע גנומי ויצירת ורייאנטים של אורגניזמים הנתונים לברירה טבעית.
שלילת מסיח ג׳- P-element, הוא כן דוגמה ל-DNA-only Transposon בדרזופילה ולכן תשובה זו אינה נכונה.
להרחבה- Alberts, מהדורה 7, עמ׳ 308-309
מולקולרית 3 שאלה 6
אם מדגירים תאים אאוקריוטים עם אורציל (Uracil) רדיואקטיבי ועושים היברידיזציה של תוצרי ה-RNA עם הדנ״א של האורגניזם, איזו תוצאה נצפה לקבל?
במה השאלה עוסקת: Uracil.
תשובה ב. הנוקלאוטיד אורציל (Uracil) הוא הבסיס החנקני שנמצא ב-RNA במקום הטימין (Thymine) של ה-DNA. ההבדל בין אורציל לטימין הוא שלאחרון יש קבוצת מתיל (CH3) בעמדה 5′ עליו (ולכן נקרא לעיתים 5′-Methyl Uracil). הבדל קטן זה מהווה כחלק מסימני האבחנה בין גדילי ה-RNA ל-DNA. כאשר יופיע נוקלאוטיד אורציל בגדיל ה-DNA, כמו למשל במקרה של דה-אמינציה(Deamination) ספונטנית של ציטוזין (Cytosine), תהליך המתרחש כ-100 פעמים ביום בערך, אנזימי התיקון של ה-DNA יזהו בסיס זה כ”זר” מכיוון שהוא לא נמצא כדרך קבע ב-DNA. ולכן כאשר נסמן את האורציל רדיואקטיבית נראה אותו רק בגדילי ה-RNA ולא ב-DNA. כמו כן, כאשר מבצעים היברידציה (Hybridization) כלומר יצירת קשרי Base pairs בין שני הגדילים, הגדילים התחברו רק בצורה חלקית ממספרסיבות, כגון אינטרונים שהוצאו מגדיל ה-RNA אך גם נמצאים בדנ”א(כי משם שועתקו) ומודיפקציות רבות שנעשו לאחר שעתוק גדיל הרנ”א כגון ה-Poly-A tail וה-5′ Cap שאינם קיימים בדנ”א ולכן לא ישתתפו בהיברידציה.
שלילת מסיחים:
א’. כפי שנאמר מעל, הדנ”א אינו מכיל בסיסים מסוג אורציל, וכן תתרחש בו איזושהי מוטציה והיווצר בסיס של אורציל בדנ”א הוא יתוקן מידית ע”י מנגנון התיקון BER (Base excision repair) שבו האנזים Uracil DNA glycosylase יסיר את הבסיס החנקני, ו-AP endonuclease יחד עם phosphodiesterase יחתכו את הבסיס הסוכרי (דיאוקסיריבוז שמחובר לפוספט)ובסוף DNA polymerase ו-DNAligase ישלימו את החסר.
ג’. מכיוון שאורציל מהוה שתחליף לבסיס החנקני טימין, הוא ימצא בדיוק באותם מקומות שטימין נמצא ב-DNA , כלומר הוא אינו מוקבל לאינטרונים (Introns) או רק לאקסונים (Exons), האורציל יכול להימצא לאורך כל גדיל ה-RNA ולכן מסיח זה אינו נכון.
ד’. בהמשך לתשובות מעל, לא רק שהתא האאוקריוטי ישתמש בבסיסים של האורציל ולכן נראה את ה-RNA מסומן רדיואקטיבית, יש אפילו אנזים מיוחד שיוצר את הבסיס אורציל במכוון כחלק מתהליך עיבוד ה-RNA (RNA editing). ראייה לכך ניתן לראות ב-2 האיזופורמים של החלבון Apolipoprotein B אשר באחד מהם (זה שמבוטא במעי) נוצר Stop codon חדש עקב השינוי,ובאחר (בכבד) לא נעשה השינוי.
מולקולרית 4 שאלה 19
מה מהבאים אינו נכון לגבי תהליך הRNA processing שמתרחש בtRNA?
תשובה ב‘. מולקולת ה-tRNA (שפירושה Transfer RNA) מקודדת ע”י RNA polymerase III באאוקריוטים, ולרוב מזוהה בשתי צורות עיקריות: הראשונה היא צורת התלתן (Cloverleaf) במבנה השניוני שלה (Secondary structure) והשנייה היא צורת האות “L” הפוכה במבנה השלישוני שלה (Tertiary structure). כמו הרבה מולקולות אחרות ה-tRNA עוברות גם עיבוד RNA על מנת להפוך לפעילים. בדומה לתהליך השחבור (Splicing) שעוברים גדילי ה-mRNA גם ה-tRNA עוברים סוג של שחבור אך לא ע”י הספלייסוזום בציטופלזמה, אלא מספר אנזימים אחרים שנמצאים בגרעין התא (Cell nucleus) כגון multifunctional tRNA ligase ואנדונוקלאז (Endonuclease) מיוחד. מכיוון שתהליך הספלייסינג נעשה בגרעין ולא בתא, תשובה זו אינה נכונה ונסמן אותה.
שלילת מסיחים:
א’. גדיל ה-tRNA נוצר כגדיל אחד ארוך אשר עובר חיתוך בקצותיו, תהליך זה נקרא Trimming (“קיטום”) והוא חשוב לקיפול נכון של המולקולה בהמשך.
ג’. אכן כל גדיל tRNA חייב לעבור מספר מודיפיקציות שונות, בממוצע אחד לכל 10 נוקלאוטידים יעבור מודיפיקציה או התמרה כלשהי. אחת ההתמרות הנפוצות ב-tRNA היא הדה-אמינציה (Deamination) של אדנין אשר יוצרת את הבסיס המיוחד אינוזין (Inosine).
ד’. כל העיבודים הנ”ל יכולים להתרחש הן בפרוקריוטים והן באאוקריוטים.
להרחבה – Alberts, מהדורה שביעית, עמ’ 359-361 (tRNA).
מולקולרית 2 שאלה 14
מה מהבאים שגוי לגבי רקומבינציה הומולוגית?
במה השאלה עוסקת: רקומבינציה הומולוגית
תשובה ג‘. תשובה שיכולה מעט לבלבל מאחר וחצי מהתשובה הוא נכון וחצי אינו נכון.
רקומבינציה הומולוגית היא כנראה מנגנון התיקון הורסטילי ביותר שקיים בתא; הוא משרת כל מטרה, דבר המסביר מדוע המנגנון והחלבונים שמבצעים אותו נותרו שמורים בכל היצורים על כדור הארץ. עם זאת צריך לזכור כי רקומבינציה הומולוגית מתרחשת רק לאחר שהדנ”א עבר שכפול (שלב S ושל G2 של חלוקת התא), כשהכרומטידה האחות יכולה לשמש כתבנית. מכאן שתשובה זו אינה נכונה לגבי רקומבינציה הומולוגית שכן היא אינה מתרחשת בכל שלב.
שלילת מסיחים:
א’. רוב האורגניזמים מיישמים את שני המנגנונים (איחוי קצוות לא הומולוגיים ורקומבינציה הומולוגית) על מנת לתקן שברים דו גדיליים בדנ”א. בבני אדם, שברים דו גדיליים לרוב יתוקנו במנגנון איחוי קצוות לא הומולוגיים
ב’. אחד התפקידים החשובים ביותר של הרקומבינציה הוא חילוץ מזלגות שכפול תקועים או שבורים שנוצרו כתוצאה של שבר חד גדילי. כשהמזלג יגיע לאיזור הפגום, הוא יתפרק וייפול – דבר היוביל ליצירה של כרומוזום בת אחד תקין וכרומוזום בת אחד שבור. המזלג השבור יכול לעבור תיקון בצורה מושלמת באמצעות רקומבינציה הומולוגית.
ד’. כפי שנאמר מעל, רקומבינציה הומולוגית מתרחשת רק בהגעה לשלבים S ו-G2 מאחר ובהם ניתן להשתמש בכרומטידה האחות כתבנית לתיקון השבר הדו גדילי בכרומטידה האחרת.
להרחבה- Alberts, מהדורה 7, עמ׳ 296-300
מולקולרית 3 שאלה 9
איזה מהמשפטים הבאים מתאר בצורה הנכונה ביותר את תפקיד פקטור השעתוק?
במה עוסקת השאלה- פקטורי שעתוק כלליים. תשובה נכונה- ב׳.
הסבר- פקטורי השעתוק הכלליים מאפשרים את איניציאציית השעתוק באאוקריוטים. הם בעלי תפקידים שונים, כשכל אחד מזהה אלמנטים שונים או מצטרף לתהליך האיניציאצייה בשלב אחר. TFIIH בעל שלושה תפקידים- הוא פותח את הדנ״א וכך מכין את הדנ״א לתהליך השעתוק, הוא מזרחן את סרין בעמדה 5 על זנב ה-CTD של רנ״א פולימראז 2 ומשחרר את רנ״א פולימראז מהפרומוטור. כלל התפקידים שלו נחוצים על מנת להתחיל את תהליך השעתוק ולקדם אותו.
שלילת מסיחים-
א. לא נכון. תפקידו של TFIIA הוא לייצב את הקשירה של TFIID. בנוסף, הוא לא מגיע בהכרח בכל תהליך של שעתוק.
ג. לא נכון. TFIID מזהה את ה-TATA Box אך לא רק, הוא מזהה גם את INR ואת BRE.
ד. לא נכון. תפקידו של TFIIE הוא למשוך את TFIIH.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 331-334
מולקולרית 2 שאלה 9
איזה משפט מהבאים הוא נכון לגבי Rad51 ?
במה עוסקת השאלה- Rad51.
תשובה ג. החלבון Rad51 (שנקרא RecA בפרוקריוטים) משתתף במספר רב של תהליכים בגרעין שבהם מתרחש Stand exchange נקרא גם Strand Invasion . בתהליך זה, התא משתמש בכרומוזום אחד על מנת לתקן את הנזק שנעשה בכרומוזום ההומולוגי לו. כלומר, גדיל אחד שמגיע מהכרומוזום התקין משמש כתבנית (Template) ומתחבר בזיווג בסיסים לגדיל בכרומוזום ההומולוגי לו בקרבת אתר הנזק. יצירת זיווג הבסיסים בין הגדילים שנמצאים על כרומוזומים שונים נקראת .Strand exchange בתהליך זה החלבון מתחבר בצורה קואופרטיבית (Cooperatively) לגדיל ה”פולש” ומונע ממנו להתקפל על עצמו ולשמש כתבנית ל-DNA polymerase לתיקון הנזק. תחילה, Rad51 (או Rec A ) מתחבר ל-ssDNA החשוף ע”י יצירת קשר עם קודון שלם (שלושה נוקלאוטידים) וכך מגיעים עוד מונומרים של Rad51 שגם יתחברו לקודונים שאחריו ליצירת פילמנט (Filament) אחד ארוך שיכסה את כל ה-ssDNA. בסוף תהליך ה-Strand exchange ה-Rad51 יבצע הידרוליזה ל-ATP שמחובר אליו מה שיגרום להתנתקותו מהכרומוזום.
שלילת מסיחים:
א .הוא אכן נקשר בצורה קואופרטיבית לDNA אך לחד גדיל ולא לשני הגדילים יחד.
ב . החלבונים BRCA1 ו-BRCA2 פועלים במנגנון התיקון של רקומבינציה הומולוגית. מוטציות בהם מעלות את הסיכון לחלות בסרטן השד. BRCA1 אחראי על רגולציית עיבוד הקצוות החשופים באתר הנזק, ולכן כאשר חלבון זה לא יתפקד התא יעבור להשתמש במנגנון התיקון של רקומבינציה לא הומולוגית (NHEJ). ו-BRCA2 אחראי לעיכוב Rad51 (ע”י קשירתו) כל עוד התא לא זקוק לו. בנוסף הוא אחראי לשינועו לאתר הנזק בקרבת ה-ssDNA החשוף. לסיכום, במסיח זה תפקידם של BRCA1 ו-BRCA2 רשומים הפוך ולכן הוא לא נכון.
ד . כפי שנאמר מעל, כל מונומר של RecA ו-Rad51 מתחבר ל-3 בסיסים, ולא אחד. ולכן מסיח זה אינו נכון.
להרחבה- Alberts, מהדורה 7, עמ׳ 298-299
מולקולרית 2 שאלה 1
מה מהבאים עשוי להביא לשינויים בתכונות האורגניזם?
תשובה ד . זו שאלה מאוד כללית, שחשוב לדקדק ולהבין את המשמעות של כל תהליך מבחינת הגנוטיפ והשלכות שלהן מבחינה פנוטיפית . כמעט כל שינוי מבחינה גנוטיפית בגנום יגרור שינוי כלשהו, גם עם המינורי ביותר, בפעילות התא ועקב כך לשינוי כלשהו בתכונות האורגניזם (הפנוטיפ שלו). פעמים רבות לא ניתן לדעת את ההשפעה של שינוי כלשהו על האורגניזם עקב מורכבות תהליך ביטוי הגנים. דוגמה נפוצה לשינוי שאינו כרוך בהשפעה על הפנוטיפ נמצא במוטציות שקטות (Silentmutations) שבהן יש שינוי בנוקלאוטיד מסוים שאינו גורר שינוי בקודון עצמו, כלומר הוא מקודד לאותה ח. אמינו ולכן לא יהיה שינוי בחלבון.
שלילת מסיחים:
א. למוטציות גנטיות, אפילו הקטנות ביותר, יכולות להיות השפעות מרחיקות לכת על הפנוטיפ, וחלקן יכולות לגרום אף למוות. המוטציה יכולה לפגוע בכל אחד משלבי תהליך ביטוי הגנים כגון שעתוק, עיכוב או הפעלה ביתר של חלבונים מסוימים ועוד.
ב. ישנם סוגים רבים של רקומבינציות, המשותף לכולן הוא שהן כרוכות בהחלפה של מקטעי גנים בין כרומוזומים או בתוך אותו הכרומוזום. החלפות אלו יכולות לגרור שינויים קריטיים בפנוטיפ של האורגניזם.
ג. שינויים במספר הכורמוזומים, מה שנקרא אנופלואידיות (Aneuploidy) יכולים לגרום לשינויים מאוד גדולים בפנוטיפ, כגון בתסמונת דאון (Down syndrome) שבה יש עודף של כרומוזום 21 מה שגורם ליכולות קוגנטיביות ירודות, שינוי במבנה צורת הפנים וכדומה.
הערת המחברים- כמובן שלכל אחד מהסעיפים יש דוגמאות בספר בהן השינוי הגנוטיפי לא הוביל לשינוי פנוטיפי. שימו לב, שבשאלה נשאלנו מה ״עשוי״ להוביל לשינוי פנוטיפי ולכן כלל התשובות נכונות שכן, כל סעיף בין א׳-ג׳ יכול להוביל לשינוי בפנוטיפ האורגניזם.
להרחבה- Alberts, The Cell 7th Ed., עמ׳ 519-524
נושא: מולקולרית 2 תת נושא: נזקי דנ״א ומנגנוני תיקון, מוטציות, תת תת נושא: מוטציות ונזקי דנ״א-הקדמה
שם הספר: Alberts מהדורה- 7 פרק- 8
מולקולרית 3 שאלה 2
מי מהרצפים הבאים נמצא בתעתיק הRNA הראשוני אבל לא ב-mRNA הבוגר?
במה השאלה עוסקת: mRNA.
תשובה ד. גדיל ה-mRNA הואRNA אשר מקודד לחלבון. רנ”א זה משועתק ע”י ה-RNA polymerase II בגרעין האאוקריוטים או מ-RNApolymerase הרגיל של הפרוקריוטים בציטופלזמה שלהם. לאחר השעתוק גדיל זה נקרא pre-mRNA ונדרשים מספר מודיפיקציות ועיבודים שונים על מנת להפוך אותו ל-mRNA “הבוגר” שמוכן לתרגום (Translation)) בציטופלסמה. אחד התהליכים החשובים בהפיכתו ל-mRNA בוגר הוא תהליך השחבור(Splicing), שבו נחתכים האינטרונים (Introns) מהגדיל ורק האקסונים (Exons) יוצאים מהגרעין. תהליך הוצאת האינטרונים נעשה ע”י הקומפלקס ספלייסוזום(Spliceosome) אשר יוצר לולאות בצורת לסו באינטרונים על מנת לנתקם מהגדיל. תהליך זה כרוך בקשירתו של נוקלאוטיד מסוג אדנין (Adenine) לקצה 5′ של האינטרון ויצרת הלולאה היוצאת (Excised lariat), כפי שניתן להבין, אותם נולקאוטידים מסוג אדנין אינם נמצאים ב-mRNA הבוגר ולכן תשובה זו היא הנכונה.
שלילת מסיחים:
א’. תהליך יצירת זנב פולי-A (poly-A tail) אשר נקרא פוליאדנילציה (Polyadenylation) הוא תהליך יצירת זנב ארוך של נוקלאוטידים מסוג אדנין בקצה 3′ של גדילה-mRNA ע”י פולימראז מיוחד שנקרא PAP (poly-A polymerase). . הזנב המיוחד הזה מקנה הגנה לגדיל, מאפשר את העברתו מהגרעין לציטופלזמה ומשתתף בשלב אינציאציית התרגום(Translation initiation). . הפוליאדנילציה מתרחשת עוד בגרעין מיד לאחר השעתוק ולכן נראה את זנב הפולי-A גם ב-pre-mRNA וגם ב-mRNA הבוגר, ולכן מסיח זה אינו נכון.
ב. קודון העצירה (Stop codon) הוא הקודון שמורה לריבוזום (Ribosome) לגייס את פקטור השחרור (Releasefactor) לאתר A (A site) ולגרום לניתוק השרשרת הפוליפפטידית ממנו. ישנם 3 סוגים של קודוני עצירה – UAA, UAG ו-UGA (אני אוהב לזכור אותם כ”או-אה”, “או-אג” ו-“עו-גה”),כמובן שקודונים אלו נמצאים גם בגדיל הרנ”א הראשוני (pre-mRNA) וגם ב-mRNA הבוגר כי הכרחיים לתפקודו של ה-mRNA. ישנם מצבים אבנורמליים שהם לא יופיעו בגדיל ה-pre-mRNA מה שנקרא Nonsense mutation אך מנגנון ה- Nonsense-mediated mRNA decay ישמיד את הגדיל עדו בתהליך השחבור ולא יתן לו לעבור עיבודים נוספים על מנתשלא יעבור לציטופלזמה לתרגום.
ג’. כפי שנאמר מעל, גם קודון הפתיחה (Start codon) – AUG ימצא בגדיל ה-mRNA הבוגר, וכמו כן גם הרצפים שנמצא במעלה הזרם שלו (Upstream). רצפים אלו נקראים UTR (Untranslated region) והם נמצאים גם בקצה ה-5′ של הגדיל ובקצה ה-3′ שלו. רצפים אלו לא מקודדים לח.אמינו אך הם חשובים והכרחיים לתרגומו ולכן נמצא אותם בגם בגדיל הראשוני וגם בבוגר.
להרחבה – Alberts, מהדורה שביעית, ע”מ 339-340 (Splicing), ע”מ 347-348 (Polyadenylation), ע”מ 359 (Stop codons), ע”מ 378-379 (Nonsense-mediated mRNA decay) וע”מ 459-460 (UTR).
מולקולרית 5 שאלה 13
מי מהבאים נכון בהקשר של P-bodies?
התשובה הנכונה היא א’- ה-Processing bodies (או בקיצור P-bodies) הם אזורים בתא אשר בהם מתרחשת רגולציה על תהליך התרגום (Translation). באזורים אלו, אשר נמצאים בציטופלזמה, ישנו עיכוב או פירוק של גדילי ה-mRNA. חלק מה-mRNA יעברו ממנו לעבר ה-Stress granule אשר מכילים מספר רב של פקטורי אינציאציה (Translation initiation factors), חלבונים קושרי זנב Poly-A ואת תתי-היחידות הקטנות של הריבוזום. ב-Stress granule ה-mRNA יעבור למצב של “Translation-ready” שבו הוא מוכן להתחיל תרגום.
שלילת מסיחים:
ב. חשוב לזכור שתהליך התרגום מתרחש בציטופלזמה ולכן אין סיבה שה-P-bodies יהיו בגרעין התא (Nucleolus), ולכן מסיח זה אינו נכון.
ג. אכן ה-P-body מכיל מספר רב של אנזימי עיכול כגון Dcp1a שהוא אנזים שמסוגל לפרק את ה-5′-Cap (סוג של Decapping enzyme) ו-Argonaute שקשור במנגנון הפרעת רנ”א (RNAi = RNA interference), אך זהו לא אברון (Organelle) במלוא מובן המילה, מכיוון שהוא לא תחום בממברנה משל עצמו, ולכן מסיח זה אינו נכון.
ד. כפי שנאמר מעל, חלק מה-mRNA שנמצאים ב-P-body עוברים רק עיכוב זמני וחוזרים לעבור תרגום, ולכן זה לא נכון.
להרחבה – Alberts, מהדורה שביעית, עמ’ 461 (P-bodies)
מולקולרית 1 שאלה 9
איזה סוג של קשר כימי נמצא בין בסיסי הDNA בהליקס הדו גדילי (double helix)?
תשובה א. כאשר מתייחסים למבנה ההליקס הדו-גדילי (Double Helix) של ה-DNA ההתייחסות היא למבנה השניוני (Secondary structure) שלו, כלומר לצורה הדו-ממדית שהמולקולה רוכשת. לרוב, מבנים שניוניים מתבססים על קשרי מימן (Hydrogen bonds) כמו במבנים שניוניים בחלבונים. כמשתמע משמו, קשר המימן הוא קשר כימי הנוצר בין אטום מימן לבין אחד מאטומי ה-NOF (חנקן, חמצן ופלואור, בהתאמה), קשר זה הוא קשר קוטבי המאפיין לרוב קשרים בין מולקולריים. בדנ”א, קשרי מימן אלו נוצרים בין בסיסים מסוג פירמידינים (Pyrimidines) לבין בסיסים מסוג פורינים (Purines), אחד בצורת טבעת חנקנית אחת והשני בנוי משתי טבעות חנקניות, בהתאמה. בין הבסיס החנקני מסוג פורין שנקרא אדנין (Adenin) לבין הבסיס החנקני מסוג פירימידין שנקרא טימין (Thymine) נוצרים 2 קשרי מימן. וכן, בין הפורין גואנין (Guanine) לבין הפירימידין ציטוזין (Cytosine) נוצרים שלושה קשרי מימן (ולכן זיווג הבסיסים האחרון מעט חזק יותר.(
שלילת מסיחים:
ב . קשר יוני (Ionic bond) הוא קשר הנוצר בין יונים בעלי מטען שונה, כלומר בין אניון (יון חיובי) לקטיון (יון שלילי). קשר זה נוצר עקב משיכה אלקטרוסטטית בין היונים, בהקשר הדנ”א לרוב נראה קשרים מסוג זה בהקשר מתכות שונות, כגון במבנה ה-Zinc finger של פקטורי שעתוק (Transcription factors)– בין יון האבץ לבסיסים ב-Major groove.
ג . קשרים קוולנטים (Covalent bonds) נמצאים בעיקר במבנים ראשוניים (בחלבונים ובחומצות גרעין כאחד), קשרים אלו חזקים מאוד ודרושים לשמירת מבנה הבסיס של המולקולה. בהקשר הדנ”א קשרים קוולנטים מחברים בין הבסיסים החנקניים שנמצאים באותו חד-גדיל, אשר שם הם נקראים קשרים פוספודיאסטרים (Phosphodiester bonds). קשרים אלו מחברים בין אטום פחמן בבסיס חנקני אחד לאטום פחמן בבסיס צמוד ע”י אטום של פוספט.
ד . קבוצת סולפהידריל (Sulfhydryl group) היא אטום גופרית (S) אשר מחובר לאטום מימן (H), קבוצה זו יכולה להתחבר לקבוצת סולפהידריל נוספת וליצור קשר דיסולפידי (S-S) שהוא קשר מאוד חזק שמאפיין בעיקר מבנים שלישוניים (Tertiary structure) בחלבונים! מכיוון שקשרים אלו מתפרקים מהר בנוכחות פרוטונים (ולכן נמצאים בעיקר בסביבות חוץ תאיות שכן בתא יש הרבה פרוטונים). קשרים אלו אינם משתתפים בזיווגי הבסיסים ולכן מסיח זה אינו נכון.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 3-5
מולקולרית 1 שאלה 4
מי מבין ההיגדים הבאים המתייחסים לטלומרים
(Telomeres) והאנזים טלומראז (Telomerase) נכון?
הסבר: תשובה ד. במה עוסקת השאלה: Telomerase.
תשובה ד. הטלומראז (Telomerase) הוא אנזים אאוקריוטי מסוג ריבונוקלאופרוטאין (Ribonucleoprotein) אשר אחראי על הארכת הטלומרים (Telomers) בקצה 3′ בכרומוזומים. בעזרת פעילות זו, הטלומראז נותן מענה לבעיית הקצוות (Endreplication problem) אשר מתרחשת באאוקריוטים עקב אי יכולתו של הפולימראז בסינתזת קצוות הכרומוזום. הטלומראז מכיל גדיל רנ”א מסוג lncRNA אשר ממנו הוא מסנתז רצף חוזרני של GGGTTA בקצה 3′ של הכרומוזום, הארכת הקצה מאפשרת ל-DNA polymerase להמשיך ולהאריך את קצה 5′ של הכרומוזום. יצירת גדיל DNA על בסיס תבנית של RNA נקראת RNA dependent DNA polymerase אשר כזכור קיימת גם באנזימיה-Reverse transcriptase, ולכן תשובה זו היא הנכונה.
הערת המחבר – כאשר חלה ירידה בפעילות אנזימי הטלומראז או בכמותם בתא, הטלומרים יתקצרו לאחר כל תהליך שכפול, דבר שיחשוף אותם לנזקים אפשריים. כאשר יתרחש נזק כזה התא יפעיל מנגנוני עצירה למחזור התא (cell cycle arrest) אשר ימנעו הכפלה נוספת. תופעה זו נקראת “Replicative cell senescence” והיא מתארת את “הזדקנות” התא. התקצרות זו של הטלומרים יכולה להתרחש גם בדרכים לא טבעיות, למשל במחלת Dyskeratosis congenita, שבה אחד מהגנים שממנו משועתק רצף תבנית ה-RNA של הטלומרז עבר מוטציה כלשהי אשר מונעת את פעילותו. אנשים הסובלים ממחלה זו יהיו בעלי טלומרים קצרים ויחוו תסמיני זקנה מוקדמים כגון פיגמנטציה של העור, שחמת בכבד וכשל במוח העצם מכיוון שאלו תאים בעלי Cell cycle מאוד מהיר ותדיר.
שלילת מסיחים:
א׳ ישנם המון סוגים של רצפים חוזרניים (Repeated sequences) לאורך הכרומוזום, למשל רצפי LINE, SINE, Satellite וכדומה. הרצפים החוזרניים של הטלומר (GGGTTA) אינם נמצאים לכל אורכו של הכרומוזום אלא רק בקצוותיו, מכיוון שזהו רצף מיוחד אשר מושך אליו חלבון שנקרא Shelterin שהווה כשכבת הגנה נוספת לקצוות הכרומוזום כנגד נזק אפשרי.
ב׳ רצף הטלומר החוזרני משתנה מאוד בין אורגניזמים שונים, אך ללא ספק הוא אינו עשיר בזיווגי בסיסים שלאדנוזין-טימידין (AT-rich), למשל באורגניזם האאוקריוטי Tetrahymena הטלומר מכיל GGGGTTG או כפי שהודגם מעל, בבני אדם הרצף בטלומר הוא GGGTTA (אשר מכילה 50% רצפי AT-rich). הסבר אפשרי לשכיחות הנמוכה יותר(לרוב) של AT-rich בטלומר טמונה בחוזק קשר גבוה יותר בזיווג הבסיסים של GC אשר מוסיף עוד שכבת הגנה לקצוות הכרומוזום.
ג׳ כפי שנאמר,לטלומראז פעילות של RNA dependent DNA polymerase, כלומר הוא מסנתז דנ”א מתבנית של רנ”א, ולכן תשובה זו אינה נכונה.
להרחבה– Alberts, מהדורה שביעית, ע”מ 281-283 (Telomerase).
מולקולרית 4 שאלה 24
מה הוא סדר הפעולות הנכון בתהליך הטענת הtRNA?
- tRNA מתחבר לAminoAcyl-tRNA synthetase
- שחרור tRNA
- ח. האמינו מתחברת לAminoAcyl tRNA-synthetase
- שחרור פירופוספט
- אקטיבציית ח. האמינו
- יצירת קשר אסטרי
- שחרור AMP
תשובה ב‘. האנזים Aminoacyl-tRNA synthetase אחראי על תהליך טעינת ה-tRNA (נקרא tRNA charging) בח. האמינו המתאימה לו. באאוקריוטים, ישנם כ-20 סוגים של Aminoacyl-tRNA synthetase בתאים, אחת לכל סוג של חץ אמינו, לעומתם, בפרוקריוטים יש פחות מ-20 מכיוון שכל Aminoacyl-tRNA synthetase מסוגל לטעון מספר סוגים של ח. אמינו. תהליך הטעינה: בהתחלה האנזים מתחבר לח. אמינו הנכונה, ואז הוא מבצע הידרוליזה ל-ATP ומשחרר פירו-פוספט לציטופלזמה. בתהליך זה הוא יוצר תוצר לוואי של Adenylated amino acid. לאחר מכן, האנזים מתחבר ל-tRNA המתאים ומשחרר את ה-AMP שהיה מחובר לח. אמינו. ע”י כך, נוצר קוולנטי חזק מסוג אסתר (Ester bond) בין ח. אמינו ל-tRNA. ולבסוף, האנזים משחרר את Aminoacyl-tRNA.
להרחבה – Alberts, מהדורה שביעית, עמ’ 361-363 (Aminoacyl-tRNA synthetase).
מולקולרית 5 שאלה 20
האם יכול להתרחש תרגום של mRNA שאינו מכיל CAP5?
התשובה הנכונה היא א’- רוב התרגום בתא האאוקריוטי נעשה דרך סריקת ה- mRNA מקצה ה- 5’cap ועל ידי קישור ה- 5’capעל ידי eIF4E. אולם, ישנו מנגנון אינציאציית תרגום שעוקף את השימוש בפקטור eIF4E ועקב כך, גם אינו קושר את קצה ה- 5’cap. מנגנון זה בשימוש נרחב בעיקר על ידי וירוסים של יונקים. שכן, וירוסים הרבה פעמים חוסמים את מנגנון התרגום הרגיל התא (דרך eIF4E) ובגלל שהם טפילים של מנגנון התרגום (זאת הסיבה שהם לא עצמאיים, לא מסוגלים לתרגם בעצמם את החלבונים שלהם), הם צריכים עדין לגרום לתא אליו הם פלשו לתרגם את החלבונים שלהם. הם עושים זאת על ידי מבני IRES ב- mRNA. אותם מבנים מיוחדים מכוונים את קומפלקס התרגום ל- AUG הרלוונטי, שהוא גם לא בהכרח ה- AUG הראשון מתחילת ה- mRNA. שכן, אין סריקת את ה- mRNA מתחילתו ועל כן לא צריך להתחיל את מסגרת הקריאה מתחילתה. חשוב לשים לב כי המנגנון קיים גם אצל יונקים אך הוא אינו מנגנון התרגום המועדף בתא, וירוסים בסך הכל מנצלים אותו.
שלילת מסיחים:
ב. החלבון Xrn1 הוא אקסוריבונוקלאז מכיוון 5′ ל- 3′. הוא קשור בפירוק mRNA ולא בתרגומו. אינו מופיע בסילבוס אלא מובא כאן כדוגמא למצב בו ישנה שאלה בה אחד המסיחים אינו מוכר לנו כלל ונוכל לדעת את התשובה לפי החומר שאנחנו כן מכירים. קורה לעיתים נדירות מאוד, אך הבוחנים יכולים לעשות ככל העולה על רוחם במבחן
ג. רצפי IRES נקשרים דווקא לפקטור eIF4G.
ד. זהו מנגנון התרגום הרגיל בתא, גם בתשובה עצמה ניתן להבין שיש שימוש ב-5’cap, מכאן שהמסיח לא עונה על השאלה.
להרחבה – Alberts, מהדורה שביעית, עמ’ 458-459 (IRES)
מולקולרית 5 שאלה 7
חלבונים בעלי מוטיב אצבע אבץ (zinc finger) וחלבונים בעלי מוטיב helix-turn-helix הם:
התשובה הנכונה היא א’- המוטיבים zinc finger ו- helix turn helix הם מוטיבים שנמצאים בפקטורי שעתוק. פקטורי שעתוק, מעצם היותם חלבונים שמעודדים שעתוק DNA, קושרים רצפי DNA ספציפיים באמצעות אותם מוטיבים. בעצם, אותם מוטיבים בנויים כמוטיבים קושרי DNA ברמת ספציפיות גבוהה לרצף.
שלילת מסיחים:
ב. פקטורי שעתוק, כשמם כן הם, מעודדים ומשפיעים על תהליך השעתוק בתא. לא על תהליך התרגום.
ג. כאמור בהסבר למסיח ב’, פקטורי שעתוק רלוונטים לתהליך השעתוק. המוטיבים הנ”ל נפוצים בפקטורי שעתוק ולא בחלבונים ריבוזומליים.
ד. שוב, אין לפקטורי שעתוק קשר לתהליך התרגום, כזכור, tRNA זו מולקולת השליח שמתאמת בין ח. האמינו שנוספת לרצף הפפטיד שמתהווה לקודון ב- mRNA. מולקולת ה- tRNA מכילה רצף anticodon שמתאים בזיווג בסיסים ל- codon ואת ח. האמינו המתאימה לקודון, שנוספה על ידי aminoacyl-tRNA synthethase. בעיה נוספת במסיח זה היא שלא מדובר על תהליך השכפול גם כן. tRNA משתתף בתהליך התרגום ופקטורי שעתוק בתהליך השעתוק.
להרחבה – Alberts, מהדורה שביעית, עמ’ 404-405 (Motifs)
מולקולרית 4 שאלה 9
מסגרת הקריאה (open reading frame) של אנזים מסוים מורכבת מ102 נוקלאוטידים. מה תהיה, ככל הנראה, ההשפעה של מוטציית השמטה נקודתית של הנוקלאוטיד ה-73?
תשובה ד‘. תחילה נחשב כמה חומצות אמינו מכיל הפפטיד לפני השפעת המוטציה. נחסיר מ-102 שלוש, שכן, השלשה האחרונה מקודדת לקודון סיום ולא לחומצה אמינית: 102-3=99. את 99 נחלק בשלוש- 99\3=33, כלומר, החלבון המקורי, מכיל 33 חומצות אמינו. מוטציית השמטה (Deletion mutation) מביאה להזזת מסגרת הקריאה (Frameshift) מנקודת המוטציה ו-Downstream אליה (כך שכבר ניתן לפסול את מסיח ב’).עכשיו ניתן לענות על השאלה באופן אינטואיטיבי. אם החלבון מכיל 33 חומצות אמינו בסה”כ, והמוטציה התרחשה בנוקלאוטיד ה-73 מתוך 102, רוב החלבון יהיה לפי הרצף התקין, כך שניתן לשלול את סעיף א’ ואת סעיף ג’. ולאלה שאוהבים בכל זאת לחשב, אם המוטציה התרחשה בנוקלאוטיד ה-73, אזי, שעד הנוקלאוטיד ה-72, הכל תקין. 72נוקלאוטידים הינם 24 חומצות אמינו (72\3) – אם מתוך 34 חומצות אמינו, 24 נשארות תקינות, זה משאיר אותנו עם 10 קודונים שהשתנו במורד הזרם למוטציה, קודון אחד מתוך העשרה זהו קודון סיום שלא מקודד לחומצה אמינית, ולכן נקבל שינו ב-9 החומצות האמיניות האחרונות – 34-24=10. 10-1=9. חשוב לשים לב, שגם אם רוב רצף החלבון תקין, אין זה אומר שהחלבון יהיה פונקציונלי באופן מלא. המוטציה יכולה לפגוע במבנהו המרחבי ולגרום לירידה בתפקודו. בנוסף. מוטציה המשנה את מסגרת הקריאה, פעמים רבות מביאה גם להופעת קודון סיום מוקדם, שכן הסיכוי להופעתו הוא 3\64.
להרחבה– Alberts, מהדורה שביעית, ע”מ 358-360 (Reading frame) וע”מ 374-375 (Stop codons).
מולקולרית 4 שאלה 2
מי מהבאים הינו תוצר ביניים בשלב הסינתזה של AA-tRNA-His בתהליך התרגום?
תשובה ד‘. תהליך טעינת ה-tRNA בחומצת האמינו המתאימה לו ולאנטי-קודון (Anti-codon) שלו, נעשית ע”י האנזים Aminoacyl tRNA synthetase. בשלב הראשון, האנזים מאקטב את החומצה האמינית ע”י AMP מ-ATP, תוך שחרור פירופוספט (Pyro-phosphate) – פעולה זו נקראת Adenylylation שבה נוצר ה-Adenylated amino acid. בשלב הבא, האנרגיה האגורה בקשר אמינואציל-AMP משמשת להעברת החומצה האמינית ל-tRNA המתאים, כך שמקבלים אמינואציל-tRNA (Aminoacyl-tRNA) –פעולה זו נקראת Esterification מכיוון שנוצר פה קשר אסתרי (Ester bond) שבו ישנו קשר בין קבוצת הקרבוקסיל של ח. האמינו לפחמן של קבוצת הריבוז (Ribose) של אחד הנוקלאוטידים ב-Aminoacyl-tRNA. חשוב לשים לב כי אנזימים אלו נחלקים ל-2 קבוצות עיקריות: Class I אשר מחברים את ח. האמינו לפחמן 2′ בריבוז, ו-Class II אשר מחברים אותה לפחמן 3′ בריבוז. בכל מקרה ח. אמינו תמיד תגיע לעמדה 3′ בריבוז עקב ריאקציית הטרנס-אספריפיקציה (Transesterification). לכל סוג של ח. אמינו קיים אנזים אשר אחראי להטענתו (ולכן יש כ-20 אנזימים כאלו). לסיכום, תוצר הביניים מתייחס לריאקציה הראשונה של תהליך הטענת ה-tRNA שבה מאקטבים את ח. האמינו (היסטדין במקרה הזה) ויוצרים AMP-His ולכן זו התשובה הנכונה.
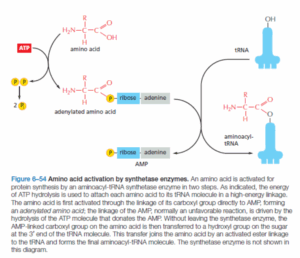
שלילת מסיחים:
א’. במולקולה AMP-tRNA-His ישנם שלושה מרכיבים: AMP, tRNA וח. אמינו היסטדין (His). לא יכול להיות מצב שבו נראה את ה-tRNA מחובר לח. אמינו כלשהי יחד עם ה-AMP כי ה-AMP יושב על המקום שבו הם צריכים להתחבר. צריך לזכור שהקשר ביניהם מתרחש בזכות ה-AMP אשר עזיבתו מאפשרת את החיבור בין הקרבוקסיל של ח. אמינו לריבוז של ה-tRNA. ולכן מסיח זה אינו נכון.
ב’. כפי שהוסבר מעל, אין תוצר ביניים שכולל בתוכו פוספט איאורגני – Pi. וכמו כן, חובה לזכור שה-ATP וה-AMP שנוצר מפירוקו משמשים ליצירת הקשר עתיר האנרגיה שמחבר בין ח. אמינו ל-tRNA ואין סיבה שפוספט כלשהו ימשיך להיות מחובר למולקולה כאשר הקשר כבר נוצר.
ג’. הפירו-פוספט אינו מתחבר בכלל לתוצרי הביניים. ריאקציית הפירוק של ATP ל-AMP ושיחרור ה-PPi יוצרת את הח. אמינו הטעונה ב-AMP. כמו כן הפירו-פוספט מפורק מיד לאחר מכן ל-2 פוספטים חופשיים.
להרחבה – Alberts, מהדורה שביעית, ע”מ 361-364 (tRNA charge).
מולקולרית 1 שאלה 10
מהו תפקידו של DNA ליגאז (ligase) בהארכה של הגדיל המפגר (lagging strand) במהלך שכפול DNA?
במה השאלה עוסקת: DNA ligase.
תשובה ג . אנזימי הליגאזות (Ligase) הם אנזימים אשר מחברים יחד שתי מולקולות ע”י שימוש באנרגיה. האנזים דנ”א ליגאז אחראי לחיבור 2 מקטעי דנ”א, או ליתר דיוק – 2 נוקלאוטידים, יחדיו ע”י יצירת קשר פוספודיאסטרי (Phosphosiester bond). פעילות זו מבוצעת ע”י פירוק ATP ל-AMP ודי-פוספט חופשי, הראשון מחובר לקצה 5′ הפנוי של אחד הנוקלאוטידים אשר הופך את ריאקציית החיבור למועדפת אנרגטית (Energetically favorable). החיבור עצמו של הניק (Nick) נעשה בצורה ספונטנית בזכות ה-AMP שבקצה 5′. הדנ”א ליגאז פועל באינספור מצבים כגון בתהליכי תיקון שונים (DNA repair), שיבוט דנ”א (DNA cloning) ובשכפול (Replication). באחרון, פעילותו של הליגאז תתרחש בעיקר בגדיל המתעכב (Lagging strand) שבו ישנה נוכחות גבוהה של מקטעים לא רציפים אשר נקראים מקטעי אוקזאקי (Okazaki fragments). אומנם, גם בגדיל המוביל (Leading strand) נראה פעילות של דנ”א ליגאז אך בצורה מאוד מצומצמת מכיוון שבגדיל זה הדנ”א שמסונתז רציף יותר.
שלילת מסיחים:
א’. כפי שנאמר מעל, רוב האנזימים מכיל כחלק הנומנקלטורה שלהם את תיאור פעילותם, כלומר כאשר נראה אנזים ששמו מכיל אתה מושג ליגאז, ניתן ישר להסיק כי תפקידו קשור בחיבור 2 מולקולות יחדיו בעזרת מטבע אנרגיה כלשהו (יכול להיות גם ATP וגם NADH). האנזימים אשר מסנתזים פריימר רנ”א מנוקלאוטידים נקראים Primase, ולכן מסיח זה אינו נכון.
ב’. הריאקציה של הארכת הטלומרים (Telomers) נעשית ע”י פולימראז ייעודי שנקרא טלומראז (Telomerase), אנזים זה איננו מסוג ליגאז ולכן תשובה זו אינה נכונה.
ד’.פעולת פתיחת הגדילים ממבנה ה-Double helix לשני חד-גדילים נעשית ע”י אנזים מיוחד שנקרא הליקאז (Helicase) אשר מבצע שבירה של קשרי המימן בין הבסיסים המקבילים בגדילים בעזרת ATP. גם אנזים זה פועל בתהליך השכפול אך הוא איננו מבצע פעילות של ליגאז (כלומר יצירת קשרים) אלא להפך – שבירה של קשרים. ולכן מסיח זה אינו נכון.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 260-261
מולקולרית 2 שאלה 17
מוטציית דה-פורינציה תגרום ל:
נושא השאלה: DNA repair.
תשובה: א. זו שאלה שמתמקדת במבנה המולקולות ובעיקר בבסיסים החנקניים ולכן חשוב להכיר את המבנה שלהם. כפי שזה נשמע דה-פורינציה (Depurination) הוא מקרה שבו מתנתק הבסיס החנקני (פורין במקרה הזה – אדנין או גואנין – לכן נשלול את מסיח ד’) עקב מולקולת מים, תהליך זה מאוד נפוץ ומתרחש אלפי פעמים ואף עשרות אלפי פעמים בתא ב-24 שעות, ולכן תשובה א’ היא הנכונה. מקרה שבו ציטוזין הופך לאורציל (Uracil) נקרא דה-אמינציה (Deamination) כלומר הציטוזין מאבד את קבוצת האמין שלו (שלילת מסיח ב’), גם מקרה שבו אדנוזין הופך לאינוזין (Inosine) הוא מקרה של דה-אמינציה מה ששולל את מסיח ג’ (האינוזין הוא בסיס חנקני שנפוץ בעיקר בtRNA.
להרחבה- Alberts, מהדורה 7, עמ׳ 287
מולקולרית 1 שאלה 23
מה נכון?
תשובה ב. יש מוטציות שמקדמות התפתחות של סרטן ע״י שינוי מבנה הכרומטין (שלילת מסיח א׳). הן עושות זאת ע״י השפעה על החלבונים שקוראים (Reader), כותבים (Writer) או מוחקים סימני היסטון , או ע״י שינוי קומפלקס ה-Chromatin Remodeling.
היסטונים הם חלבונים נפוצים מאוד, ויש להם עותקים רבים של גנים שמקודדים אותם. לכן, כדי שבאמת נראה אפקט של מוטציה עליה להיות דומיננטית ומתעלה על כמות ההיסטונים הרגילים. מוטציה רגילה שפשוט קורית, תשנה כ10% מההיסטונים ולכן על המוטציה להיות דומיננטית (שלילת מסיח ד׳). מוטציות “אונקו־היסטון” כאלה מופיעות בכ־4% מכלל הגידולים, ובחלק מסוגי הסרטן הן מהוות מנוע עיקרי לתהליך הסרטני.
דוגמה חשובה היא המוטציה שמשנה את החומצה האמינית ליזין בעמדה 27 בהיסטון H3 למתיונין (H3K27M). מוטציה זו נמצאת כמעט תמיד בסוג קטלני של גידול מוח בילדים (DIPG), ולעיתים גם בסרטן דם חריף (AML) ובמלנומה אצל מבוגרים (שלילת מסיח ג׳). החוקרים גילו ש־H3K27M נקשרת באופן חזק וחריג לקומפלקס החלבונים PCR2, ובכך משנה את הרמה של סימון H3K27me3 בכל הגנום. ממצא זה מדגיש עד כמה הטרוכרומטין חשוב לשליטה בביטוי הגנים.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 215-217.
מולקולרית 3 שאלה 8
מה נכון לגבי תהליך השחבור?
במה עוסקת השאלה: שחבור. תשובה נכונה- ד׳.
בתהליך השחבור נוצר הספלייסוזום שמורכב מsnRNPs שונים לא כולם בונים את האתר הפעיל (שלילת מסיח ב׳). הספלייסוזום הוא המבצע את ריאקציית השחבור שמורכבת משתי ריאקציות טראנס אסטריפיקציה (שלילת מסיח ג׳), אשר מתבצעות באתר פעיל המורכב מ-U6 ו-U2. באתר הפעיל שנוצר פעמיים במהלך השחבור- עבור שתי ריאקציות הטראנס אסטריפיקציה, יש יון מגנזיום (שלילת מסיח א׳).
להרחבה- Alberts, מהדורה שביעית, עמ׳ 341-345
מולקולרית 1 שאלה 6
בשנת 1928, Griffith הזריק לעכברים חיידקים מסוג S (smooth), והעכברים מתו. כאשר הוא הזריק לעכברים חיידקים מסוג R (rough), העכברים חיו. כאשר הוא הזריק לעכברים חיידקים מסוג S מתים (heat-killed), העכברים חיו. מה היתה התוצאה כאשר הוא הזריק לעכברים חיידקים מתים מסוג S יחד עם חיידקים חיים מסוג R?
במה השאלה עוסקת: Griffith’s experiment.
תשובה ד‘. הניסוי של גריפית’ (Griffith’s experiment) היה אחד הניסויים הראשונים שחשפו את תהליך הטרנספורמציה (Transformation) של החיידקים. בתהליך זה נעשית העברה של הגנום החיידקי לסביבה וממנה לחיידקים אחרים ללא מגע ישיר ביניהם. גריפית’ הראה שהחיידקים הלא אלימים (חיידקי R מסוגלים לקבל את הגנום שמכיל את הגנים שמחוללים את מחלת דלקת הריאות (Pneumonia) מחיידקים מתים (חיידקי S), ע”י החדרת חיידקים לא-אלימים (R) חיים + חיידקי אלימים (S) מתים לעכברים. החיידקים הלא אלימים קיבלו את הגנום מחולל המחלה ע”י טרנספורמציה מהחיידקים האלימים שמתו וכך רכשו את היכולת לגרום לדלקת ריאות. ולכן תשובה זו היא הנכונה.
שלילת מסיחים:
א’. כפי שנאמר מעל, העכברים מתו עקב חיידקי ה-R אשר רכשו את יכולת הפתוגניות. בנוסף לזאת, לא ידוע על מנגנון שמחזיר לחיים אורגניזמים שמתו, כך שצריך ישר לשלול תשובה זו.
ב’. אכן היה ניתן לבודד חיידקים מסוג S חיים מרקמת העכברים מכיוון שחלק מחיידקי ה-R נהפכו לאלימים ורכשו את צורת ממברנת החיידקים האלימים שהייתה חלקה (S=Smooth), אך תשובה זו אינה נכונה מכיוון שחיידקי ה-S הורגים את העכברים עקב דלקת הריאות שהם יוצרים.
ג’.מסיח זה מנסה לבלבל בין תהליך הטרנספורמציה, שמתאר העברת מידע גנטי דרך הסביבה, לצורת תהליך השכפול (Replication) .
להרחבה- Alberts, מהדורה שביעית, עמ׳ 184-185
מולקולרית 4 שאלה 13
לאיזה אזור בtRNA נקשרת החומצה האמינית?
תשובה ד‘. מולקולת Transfer RNA (בקיצור tRNA) היא סוג של RNA שמקודד ע”י RNA polymerase III אשר משמש כסוג של מתאמת (Adaptor) בין ה-mRNA לח. האמינו. ישנם מעל ל-20 סוגי tRNA (אחת לכל ח. אמינו) כל אחת באורך ממוצע של80 נוקלאוטידים. ה-tRNA עובר מספר רב של מודיפיקציות בתהליך שנקרא “עיבוד רנ”א” (RNA editing) שבמהלכו מוסיפים ומורידים ממנו נוקלאוטידים מסוימים ואף משנים אותם לגמרי – בממוצע 10 אחוז מה-tRNA עובר מודיפיקציות ושינויים. במבנה הראשוני (Primary structure) נראה את רצף הנוקלאוטידים שמרכיבים את הגדיל, במבנה השניוני (Secondary structure) הרצף מקבל צורה שדומה לעלה תלתן (Cloverleaf) שבה ניתן לראות את הזרועות (Arms) השונים של ה-tRNA כגון את זרוע האנטי-קודון (Anti-codon arm), ה-D-loop (מבנה של Stem & loop שמכיל מספר נוקלאוטידים מסוג Dihydrouridine=D), ה-Acceptor stem (שהיא הזרוע בקצה 3′ שמתחברת לח. אמינו המתאימה) וכו’. לבסוף, במבנה השלישוני (Tertiary structure) נראה את המבנה התלת-ממדי שנראה כאות “L” הפוכה. כפי שנאמר, ה-Acceptor stem (ה”זרוע המקבלת”) היא הקצה 3′ של ה-tRNA שמסתיימת ברצף הנוקלאוטידים CCA, כאשר אל ה-A מתחברת ח. אמינו בקשר קוולנטי חזק. ולכן תשובה זו הנכונה.
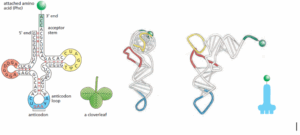
שלילת מסיחים:
א’. ה-D loop הוא חלק שבנוי בצורת Stem & loop ב-tRNA אשר מכיל מספר נוקלאוטידים מסוג Dihydrouridine. לולאה זו אינה מתחברת לח. אמינו ולכן מסיח זה אינו נכון.
ב’. כמובן שח. אמינו לא מתחברת לאנטי-קודון, כפי ששמו מעיד עליו, הוא ה”אנטי” של הקודון שנמצא ב-mRNA ואמור להשלים אותו ולהתחבר לאליו ולכן אינו יכול להתחבר בנוסף גם לח. אמינו, ולכן מסיח זה אינו נכון.
ג’. כפי שנאמר מעל, ח.אמינו מתחברת לרצף CCA אשר נמצא בקצה 3′ ב-tRNA, חשוב לזכור את הכיווניות ולא להתבלבל ביניהם.
להרחבה– Alberts, מהדורה שביעית, ע”מ 359-361 (tRNA).
מולקולרית 1 שאלה 15
חלבון קושר DNA, שאינו היסטון (Non-histone), יהיה עשיר באיזו מחומצות האמינו הבאות?
תשובה ד. ה-DNA בנוי בצורה כזו שהנוקלאוטידים (Nucleotides) נמצאים עמוק יותר במבנה המרחבי של ה-Double helix וחיצונית יותר נראה את השלד הפוספו-סוכרי (Sugar-phosphate backbone) שמחזיק אותם. כזכור, הפוספט הוא האטום שמקשר בין הסוכרים (ה-Deoxyribose או ה-Ribose במקרה של RNA) בקשר קוולטני חזק שנקרא פוספודיאסטר (Phosphodiester bond). לאחד מאטומי החמצן שעל הפוספט יש מטען שלילי אשר מקנה לכל השלד הפוספטי הזה מטען כללי שלילי. על מנת שחלבון יקשר ל-DNA הוא צריך להיות בעל מטען חיובי, כלומר עליו להכיל שיירים חיוביים של חומצות אמינו כגון ארגינין (Arginine), ולכן תשובה זו היא הנכונה. ראוי לציין כיגם להיסטונים (Histones) שבונים את הנוקלאוזומים יש אחוז גבוה שלחומצות אמינו חיוביות מסוג ארגינין וליזין (Lysine).
שלילת מסיחים:
א’. טירוזין (Tyrosine) היא חומצת אמינו פולרית עם קבוצת הידרוקסיל (OH) בשייר שלה. קבוצת ההידרוקסיל אינה נוטהליצור קשרים עם אטומים שליליים. ולכן מסיח זה אינו נכון.
ב’. חומצת האמינו אלאנין (Alanine) אינה יכולה ליצור קשרים יונים בעזרת השייר שלה מכיוון שאינה מכילה מטען חשמלי (חיובי או שלילי). ולכן מסיח זה אינו נכון.
ג’.חומצת האמינו גלוטמט (Glutamate) היא חומצת אמינו חומצית (Acidic) בעלת מטען שלילי, אשר בהכרח אינה יכולה ליצור קשר יוני עם מולקולה שלילית נוספת.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 186-187
מולקולרית 1 שאלה 24
איזה מהמשפטים הבאים מתאר בצורה הטובה ביותר את – HARs-Human accelerated regions?
תשובה ג׳. HARs, הם רצפי DNA משומרים שהצטברו בהם שינויים בקצב יוצא דופן בבני אדם, כרבע מהם גנים הקשורים להתפתחות המוח. הרצפים שהיו משומרים מאוד ברוב היונקים, אך עברו “צבירה מהירה במיוחד של שינויים בנוקלאוטידים” בבני אדם וחושבים שהם מבטאים תכונות שחשובות מאוד להבדלים בינינו לבין שימפנזות (שלילת מסיח א׳).
שלילת מסיחים:
ב. ה-HARs אינם רצפים שנמחקו מהגנום האנושי; הם השתנו, לא נעלמו.
ד. ה-HARs אינם מקטעים גדולים שאינם משתנים; הם משתנים משמעותית בבני אדם בהשוואה ליונקים אחרים.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 238-239
מולקולרית 2 שאלה 12
איזה מהמשפטים הבאים מתאר נכונה את המוטציה שלו?
במה השאלה עוסקת: Mutations types.
תשובה א. בכללי, ישנם מספר סוגים שלמוטציות כגון Point mutation שבה ישנה שינוי נקודתי של נוקלאוטיד אחד ברצף מסוים, היפוך (Inversion) שבו הגן הופך את הכיווניות שלו, מחיקה (Deletion) שבה תתרחש מחיקה של רצף מסוים וטרנסלוקציה (Translocation) שבה תתרחש העברה של מקטע לאזור אחר בגנום. מוטציית Null היא סוג של מוטציה שבה יש שינוי בגן מסוים אשר גורם לסוג Loss of function שבו יש ביטול מלא של פעילות הגן. כלומר, הגן יוצא מכלל פעולה באופן מוחלט ואינו בא לידי ביטוי כלל. זה שונה ממצב רגיל של Loss of function שבו תיתכן רמת ביטוי מינימלית כלשהי.
שלילת מסיחים:
ב’. מוטציה סופרסורית (Suppressor mutation) היא מוטציה אשר גורמת להחזרת הפנוטיפ הרגיל לאחר שאותו פנוטיפ השתנה עקב מוטציה קודמת. כלומר, זו מוטציה שממסכת על מוטציה אחרת ומחזירה את הפנוטיפ לנורמה. מוטציה זו נחלקת ל-2 סוגים עיקריים: Intragenic (שתי המוטציות באותו הגן) ו-Extragenic (שתי מוטציות שכל אחת נמצאת בגן אחר). מוטציה זו לא קשורה לעיכוב ולכן מסיח זה אינו נכון.
ג’. מוטציית Gain of function אכן גורמת להעלאת פעילות גן מסוים, אך לרוב היא תהיה מוטציה דומיננטית, מכיוון שאם תהיה רצסיבית נצטרך 2 מוטציות באותם הגנים ההומולוגים (שהסבירות להתרחשותה היא יותר נמוכה), ולכן מסיח זה אינו נכון.
ד’. ה-Conditional mutation היא מוטציה שתלויה במצבים מסוימים. במוטציה זו הפנוטיפ האבנורמלי נראה רק במצבים מסוימים שנקראים Restrictive conditions, ובמצב הרגיל (Permissive condition) הגן יעבוד בצורה רגילה. חשוב להבין כי את האפקט של הפנוטיפ ניתן לראות רק במצבים מסוימים. דוגמאות קלאסיות לסוג זה ניתן לראות במוטציות שרגישות לטמפ’ (Temperature-sensitive mutation). במוטציות אלו כאשר הטמפ’ גבוה מאוד או נמוכה מאוד נראה פנוטיפ שונה מהרגיל.
להרחבה- Alberts, מהדורה שביעית, עמ’ 522-526 (Mutations) עמוד 521 (Mutations types).
מולקולרית 5 שאלה 5
מי מההיגדים הבאים אינו נכון?
התשובה הנכונה היא א’- לאקטיבטורים של שעתוק אין יכולת שעתוק עצמונית. הם מעודדים את פעילות RNA פולימראז, אך אינם בעלי אתר פעילות פולימראז. לאקטיבטורים אתר קשירה ל- DNA, ואתר קשירה ל- RNA פולימראז, מדיאטור אופקטורי שעתוק כלליים. לעיתים יש לאקטיבטורים גם אתר קשירת קו אקטיבטור, שמפעיל אותם ומוביל להגברת שעתוק בעידודם. על כן, תשובה זו שגויה, מאחר ולאקטיבטורים אין יכולת לשעתק גנים בעצמם.
שלילת מסיחים:
ב. אקטיבטורים רק לפעמים קושרים בעצמם את RNA פולימראז ומעודדים שעתוק, בד”כ זה נעשה בתיווך חלבוני mediator. אך גם כשהם נקשרים ל- RNA פולימראז, הקישור חלש ולא יציב, שכן, RNA פולימראז בעת שעתוק מתקדם על גבי מולקולת ה- DNA. אילו היה נשאר במקום, לא היה מתרחש תהליך של הארכת השרשרת. מכאן שעל האקטיבטורים להרפות מקישור RNA פולימראז לאחר האינציאציה. תפקידם בעידוד האינציאציה בלבד, כשמתחילה האלונגציה הם מתנתקים מ- RNA פולימראז.
ג. אקטיבטורים רוב הזמן קשורים לאנהנסר מרוחק מאתר הפרומוטור, בעת קישור הם מובילים לקיפול מולקולת ה- DNA כך שהאקטיבטור נמצא סמוך לפרומוטור ל- RNA פוליראז שקשור אליו. רוב הזמן, הקישור בין RNA פולימראז לאקטיבטור מתווך על ידי קומפלקס ה- mediator. כשמו כן הוא, מקשר בין אקטיבטור ל- RNA פולימראז.
ד. באאקריוטים חלבונים רבים משתתפים בתהליך אינציאציית השעתוק, ביניהם פקטורי שעתוק כלליים, שהכרחיים לשעתוק כלל הגנים האאקריוטים, RNA פולימראז, אקטיבטורים,רפרסורים, mediator complex, חלבוני chromatin remodeling ועוד… כל אלה עובדים יחד בסינרגיה כדי להוציא את השעתוק לפועל. רמות שעתוק הגן יהיו בהתאם לחלבונים שמתשתתפים בתהליך. ללא אקטיבטור יתכן שתיהיה רמת ביטוי נמוכה. אך בתזמון מתאים והפעלת אקטיבטורים רלוונטים, רמות הביטוי יעלו. כך התא האאקריוטי מבקר את תהליך ביטוי הגנים בתא, על ידי בקרה מקיפה שתלויה בכמות גדולה של חלבונים שונים ותפקודם.
להרחבה – Alberts, מהדורה שביעית, עמ’414-416 (complex switches)
מולקולרית 3 שאלה 7
איזה מהרצפים הבאים לא נקשר לתהליך השעתוק ישירות?
במה השאלה עוסקת: Transcription sequences.
תשובה ב’. מסיח זה אינו נכון משתי סיבות, הראשונה היא שה-ORC (שהוא ה-Origin recognition complex) הוא לא רצף אלא קומפלקס של חלבונים אשר מתחבר למוצא השכפול (Origin) שעליו נבנה ה-Prereplicative complex (בקיצור preRC) שיאפשר את תחילת השכפול (DNA replication initiation). כזכור, כל עוד קומפלקס זה מזורחן (Phosphorylate) ה-PreORC לא יכול להיווצר ולכן לא יתרחש שכפול נוסף. הסיבה השנייה כפי שנאמר מעל, היא שמושג זה נקשר לשכפול ולא לשעתוק ולכן מסיח זה אינו נכון.
שלילת מסיחים:
א. רצף ה-Terminator הוא רצף פרוקריוטי שבו השעתוק מסתיים כאשרה-RNA polymerase מגיע אליו. לרוב, רצף זה מקודד לרצף רנ”א אשר מסוגל להתקפל על עצמו וליצור מבנה של סיכה (Hairpin), מבנה זה גורם להפרעה מרחבית שגורמת לניתוק הגדיל מהפולימראז ולהתנתקות הפולימראז מהדנ”א.
ג. הרצף 35- הוא גם רצף פרוקריוטי אשר נקשר לרוב לרצף 10- . שני אלו הם רצפים שנמצאים בשני צדדיו של הפרומוטר (Promoter), האחד במעלה הזרם (Upstream) והשני במורד הזרם (Downstream), בהתאמה. רצפים אלו נקראים הקסמרים (Hexamers) מכיוון שהם מורכבים משישה נוקלאוטידים כל אחד.
ד. רצף ה-TATA הוא רצף אאוקריוטי שנמצא כ-25 נוקלאוטידים במעלה הזרם ל-Start site של הגן. לרצף זה מתחברת תת-היחידה TBP (שהוא TATA binding protein) של הפקטור TFIID. ולכן גם רצף זה נקשר לשעתוק.
להרחבה – Alberts, מהדורה שביעית, עמ’ 331-332 (TATA box), עמ’ 328 (Terminator + “-35”) ועמ’ 1044 (ORC).
מולקולרית 3 שאלה 10
מה מהבאים אינו תומך בתיאוריה לפיה רנ״א התפתח לפני הדנ״א?
במה עוסקת השאלה- עולם הרנ״א. תשובה נכונה- א׳.
הסבר- שימו לב שנשאלתם מה אינו תומך בתיאוריה לפיה רנ״א קדם לדנ״א. סעיף א׳ הוא משפט נכון. הוא לקוח מפרק 1 של הספר (עמ׳ 2), אך הוא אינו משפט שמאפשר בהכרח לטעון שרנ״א קדם לדנ״א. לפי המשפט הזה, אפשר להניח שדנ״א היה קיים במקביל לרנ״א ולאו דווקא התפתח אחריו. לכן תשובה זו אינה תומכת בתיאוריה והיא התשובה השגויה.
שלילת מסיחים- כל שאר המסיחים הם משפטים המסבירים ותומכים בתיאוריה לפיה רנ״א קדם לדנ״א. היכולת של מדענים לייצר ריבוזים במעבדה, תומכת בתיאוריה לפיה ב״עולם הרנ״א״ הייתה היווצרות של מבינים בעלי יכולות קטליטיות באופן טבעי. סעיף ג׳ גם הוא תומך בתיאוריה מפני שמסביר לנו כיצד לרנ״א הייתה גם יכולת לשמר את המידע הגנטי הדרוש להישרדות האורגניזם וגם את היכולת לבצע ריאקצית שגם היא הכרחית. אם נחשוב על מולקולת דנ״א, אנחנו יודעים שתפקידה הוא לאחסן את המידע התורשתי שלנו, אך היא לבדה לא יכולה לבצע ריאקציות כימיות. גם הקיפול של רנ״א על עצמו ליצירת מבנים קטליטים כמו למשל tRNA תומכת בדיוק בכך שיכול להיות שהיה שלב באבולוציה בו רנ״א מילא את שני התפקידים- שמירה על המידע התורשתי ויכולות קטליטיות ולכן יכול להיות שהוא המולקולה הקדומה יותר מבין השתיים.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 389-392
מולקולרית 4 שאלה 8
בוצעה אנליזה גנטית עבור רצפו של גן ספציפי בפרט החולה במחלה תורשתית. החוקר זיהה מוטציה נקודתית- שינוי של נוקלאוטיד C לנוקלאוטיד T שגרמה להחלפת חומצת האמינו גלוטמין לקודון פסק. כל ההיגדים הבאים נכונים למעט:
תשובה ד‘. בניתוח גנטי (Genetic analysis) הכוונה היא לכל שיטה גנטית שבה ניתן לבחוןולאמוד את הגנום כגון Polymerasechain reaction (בקיצור PCR), קריוטיפ (Karyotype), ריצוף גנטי (DNA sequencing) וכדומה. כאשר התרחשה מוטציה נקודתית (Point mutation), כלומר החלפה של נוקלאוטיד אחד באחר אשרגורם לשינוי ח. אמינו של אותו הקודון (Codon) לקודון סיום (Stop codon) הכוונה היא Nonsense mutation. מוטציית Nonsense יוצרת חלבון קצר יותר מהרגיל עקב הופעתו שלקודון סיום באמצע האזור המקודד ב-mRNA. לרוב, מוטציה זו מתוקנת ע”י מנגנון ה-Nonsense-mediated decay (בקיצור NMD) שמסוגל לזהות את הקודון הנ”ל ע”יחלבונים מיוחדים שנקראים Exon junction complexes(בקיצור EJC) שנוכחותם מעידה על תרגום לא מלא של הגדיל –הריבוזום (Ribosome) הראשון שמתרגם את ה-mRNA אמור ל”הפיל” (להוריד) את כל ה-EJC מה-mRNA. החלפה של נולקאוטיד אחד באחר איננה מוסיפה או גורעת מסך מספר הנוקלאוטידים ולכן לא תתרחש מוטציית Frameshift שבה יש הזזה של מסגרת הקריאה ושינוי כל הקודונים עקב זאת, ולכן מסיח זה אינו נכון ואותו נסמן.
שלילת מסיחים:
א’. התמרה פשוטה (Transition mutation) היא החלפה של נוקלאוטיד אחד בנוקלאוטיד אחר כאשר הנוקלאוטידים המוחלפים הם מאותו הסוג, כלומר כאשר פורין (Purine) מוחלף בפורין או כאשר פירמידין (Pyrimidine) מוחלף בפירמידין אחר. בהשאלה זו ההחלפה הייתה בין ציטוזין לתימין ששניהם מסוג פירימידין ולכן מסיח זה הגיוני ונכון.
הערת המחבר – כזכור,פורין הוא סוג של בסיס חנקני (Nitrogenbase)שמורכב מ-2 טבעות חנקניות כגון Adenine, Guanine ו-Hypoxanthine. פירימידין הוא גם סוג של בסיס חנקני אשר מורכב מטבעת חנקנית אחת בלבד, כגון Cytosine, Thymine ו-Uracil.
ב’. פולימורפיזם (Polymorphism) הוא מושג המתאר שינוי נפוץ שחל בגנום באוכ’ מסויימת. כאשר מדובר על שינוי שבו מוחלף נוקלאוטיד אחד זה יקרא Single-nucleotide polymorphisms (בקיצור SNP) וכאשר השינוי מתרחש עקב הכנסה או מחיקה (Insertion or Deletion) של מספר נוקלאוטידים זה יקרא אינדל (Indel), במקרה של שינוי קטן, ו-CNV (שזה Copy number variations) במקרה של שינוי נרחב. לרוב, שינויים פולימופיים אלו בגנום אינם גורמים לפנוטיפ כלשהו או למחלה מסוימת. הפולימורפיזם זהבעצם השונות שיש בין בני אדם בתכונות שונות כגון צבע עור, גובה וכדומה. מכיוון שברוב המקרים לא תהיה משמעות קלינית ככל הנראה לא מדובר במוטציה הנקודתית שיוצרתקודון סיום שלו יש השלכות משמעותיות על תפקוד החלבון והתא.
ג’. מוטציה נקודתית היא החלפה שלבסיס חנקני אחד באחר, ולכן מסיח זה נכון (כלומר לא נסמן אותו).
להרחבה– Alberts, מהדורה שביעית, ע”מ 253-254 ועמוד 358(Point mutation), ע”מ 378-379 (Nonsense-mediated mRNA decay), ע”מ 525-526 (Polymorphisms)
מולקולרית 3 שאלה 5
- מה מבין ההיגדים הבאים נכון לגבי זנב ה-Poly-A?
(I) הוא מסונתז לאחר חיתוך קצה ה-3′ של mRNA.
(II) אורכו לרוב אינו עולה על 300 נוקלאוטידים.
(III) אחד מתפקידיו הוא להגן על mRNA מעיכול על ידי RNase ציטופלזמטי.
(IV) אחד מתפקידיו הוא לעודד תרגום.
במה השאלה עוסקת: Poly-A tail.
תשובה ד‘. זנב ה-Poly-A הוא גדיל של RNA שבנוי מבסיסי אדנוזין (Adenosine) אשר נמצא בקצה 3′ של מולקולות ה-mRNA הבוגרות. הפולימראז שמסנתז אותו נקרא Poly-A polymerase (PAP), בשונה משאר סוגי הפולימראזות הראשון מסוגל לסנתז נוקלאוטידים ללא צורך בתבנית (Template). ה-PAP מתחיל לפעול רק לאחר שגדיל ה-mRNA נחתך ומתנתק מה-RNA polymerase ע”י מספר פקטורים, ששניים מהם חובה להכיר – CPSF (Cleavage and polyadenylation specificity factor) ו-CstF (cleavage stimulationfactor). הראשון מתחבר לרצף הקסמרי (Hexamer) של AAUAAA לפני נקודת החיתוך(Upstream לנקודת החיתוך) והאחרון מתחבר ל-GU-rich element שנמצא אחרי נקודת החיתוך (Downstream לנקודת החיתוך). זנב הפולי-A מקנה לגדיל ה-mRNA מספר יכולות חשובים וקריטיים לפעילותו:
- תרגום – זנב ה-Poly-A משתתף באינציאציית התרגום (Translation initiation) ע”י כך שהוא מתחבר לפקטור התרגום eIF4G (ע”י חלבונים שנקראים Poly-A binding proteins) שמחובר לפקטור אחר (eIF4E) שקשור ל-5′ cap של ה-mRNA.
- הגנה – אורך זנב ה-Poly-A מסמן את אורך חיי מולקולת ה-mRNA, כאשר זנב זה מתחיל להתפרק ע”י אקסונוקלאזות (Exonuclease) שונות הוא מגיע לאורך קריטי (בערך 25 נוקלאוטידים באדם) שבו הוא מסומן לפירוק – נקרא mRNA decay.
- טרנספורט – חלבוני ה-Poly-A binding מתחברים לזנב ה-Poly-A לאחר סיום פעילותו של הפולימראז PAP והם מסמנים שמולקולת ה-mRNA מוכנה להוצאה מהגרעין ושהיא סיימה את תהליך השחבור (Splicing). ללא חיבור חלבונים אלו לא תתרחש Nuclear Export מהגרעין.
לסיכום, זנב ה-Poly-A מסונתז לאחר ניתוקה-mRNA מ-RNApolymerase ולכן היגד I נכון, אורכו הואבערך כ-200 נוקלאוטידים – היגד II נכון וכחלק מתפקידיו הרבים זנב זה תורם להגנה מ-RNase (היגד III) ותורם לאינציאציית התרגום (היגד IV) ולכן נסמן את תשובה ד’ כנכונה (כלל היגדים נכונים).
הערת המחבר – באלבטרס לא מתארים איזה חלבון הוא אחראי על חיתוך גדיל ה-mRNA בזמן השעתוק (Transcription) אך לפי מקורות אחרים לחלבון CPSF יש תת-יחידה שנקראת CPSF-73 שלה יש חיתוך והיא אשר מבצעת את החיתוך. (לא למבחן רק להעשרה שלכם)
להרחבה – Alberts, מהדורה שביעית, ע”מ 347-349 (Polyadenylation) .
מולקולרית 5 שאלה 1
מה יקרה באופרון הטריפטופן של E-coli בנוכחות רמות גבוהות של טריפטופן?
התשובה הנכונה היא ד’ – אופרון הטריפטופן קיים בפרוקריוטים (כזכור, אופרונים מאפיינים פרוקריוטים בעיקר, ומאוד נדירים באאוקריוטים) ומשמש לייצור ח. האמינו טריפטופן בעת הצורך. משמעות הדבר, שכל עוד יש טריפטופן, אין צורך בייצור טריפטופן נוסף מאחר והדבר יהווה בזבוז אנרגיה מיותר. עלכן, טריפטופן עצמו משמש כקו רפרסור לאופרון הטריפטופן. קו רפרסורים נקשרים באתרים יעודיים לרפרסור ומעודדים קישור לאתר האופרטור ובכך מעכבים שעתוק. באופן דומה, קואקטיבטורים, נקשרים באתרים יעודיים לאקטיבטור, ומעודדים קישור לאופרון, בכך, מעודדים שעתוק.
שלילת מסיחים:
א. כפי שהוסבר בתשובה ד’, בריכוזים גבוהים של טריפטופן בתא אין ביטוי של גנים מאופרון הטריפטופן, שכן אין צורך בייצור טריפטופן. על כן, גם הגן trpC לא בא לידי ביטוי.
ב. כאמור, טריפטופן הוא קו רפרסור לרפרסור של אופרון הטריפטופן. קו רפרסורים מעודדים קשירה לאתר האופרטור, ועל כן המסיח הזה שגוי.
ג. הרפרסור שלאופרון הטריפטופן עובר שינוי קונפורמציה בעת קשירת הקו רפרסור טריפטופן ומתאפשרת קשירה לאתר האופרטור. רצף האופרטור נמצא בפרומוטור של אופרון הטריפטופן כך שהפרומוטור נחסם פיזית לקשירה של RNA פולימרארז.
להרחבה – Alberts, מהדורה שביעית, עמודים 410-412
מולקולרית 4 שאלה 29
מה מהבאים אינו נכון בהקשר של תהליך התרגום של הריבוזום?
תשובה א‘. ישנם 2 מושגים חשובים שצריך להכיר בהקשר תהליך ההגהה (Proofreading) של הריבוזום. הראשון נקרא Induced fit והוא מתאר את הקיפול (ה”חביקה”)של הריבוזום על זיווג הבסיסים עוד לפני כניסת ח. האמינו לפוליפפטיד. כזכור ההבדלבין זיווג הבסיסים של T ו-A ל-G ו-C הוא בקשר מימן אחד (לראשונים 2 קשרי מימן ולאחרונים 3 קשרי מימן), ולכן כאשר לא תהיה התאמה נכונה בין הבסיסים תהייה הפרעה מרחבית שתפסיק את פעולתו של הריבוזום. בהמשך לזאת, המשוג השני שקשור לתהליך ההגה הנקרא Kinetic proofreading והוא מתאר את הזמן שלוקח לבצע הידרוליזה ל-GTP כזמן שבו הריבוזום מוודא שאכן הקודון תואם לאנטי-קודון, כלומר ישנוניצול של ההפסקה הקצרה בתהליך הקידוד לאיתור שגיאות. ה-Kinetic proofreading גורם להעלאת הספציפיות של זיווג הבסיסים מכיוון שהוא מבטל זיווגים לא ספציפיים (לא תואמים), ולכן מסיח זה אינו נכון.
שלילת מסיחים:
ב’. בפרוקריוטים, ה-16S שנמצא בתת-היחידה הקטנה אחראית על תהליך ה-Induced fit של הריבוזום והיא זו ש”חובקת” את זיווג הבסיסים, ולכן מסיח זה נכון.
ג’. כפי שנאמר מעל, ההגהה הקינטית קשורה בזמן שלוקח לבצע הידרוליזה ולכן מסיח זה נכון.
ד’. כמובן שה-Induced fit מתרחש לפני העברת ח. אמינו באתר A לפוליפפטיד באתר P מכיוון שזה בא לבדוק התאמה ונכונות של זיווג הבסיסים בשביל למנוע הכנסה שגויה של ח. אמינו ולכן מסיח זה גם נכון.
להרחבה – Alberts, מהדורה שביעית, עמ’ 365-368 (Ribosome) ועמ’ 369-371 (Induced fit + Kineticproofreading).
מולקולרית 2 שאלה 1
מה מהבאים עשוי להביא לשינויים בתכונות האורגניזם?
במה השאלה עוסקת: Phenotype & Genotype.
תשובה ד . זו שאלה מאוד כללית, שחשוב לדקדק ולהבין את המשמעות של כל תהליך מבחינת הגנוטיפ והשלכות שלהן מבחינה פנוטיפית . כמעט כל שינוי מבחינה גנוטיפית בגנום יגרור שינוי כלשהו, גם עם המינורי ביותר, בפעילות התא ועקב כך לשינוי כלשהו בתכונות האורגניזם (הפנוטיפ שלו). פעמים רבות לא ניתן לדעת את ההשפעה של שינוי כלשהו על האורגניזם עקב מורכבות תהליך ביטוי הגנים. דוגמה נפוצה לשינוי שאינו כרוך בהשפעה על הפנוטיפ נמצא במוטציות שקטות (Silentmutations) שבהן יש שינוי בנוקלאוטיד מסוים שאינו גורר שינוי בקודון עצמו, כלומר הוא מקודד לאותה ח. אמינו ולכן לא יהיה שינוי בחלבון.
שלילת מסיחים:
א. למוטציות גנטיות, אפילו הקטנות ביותר, יכולות להיות השפעות מרחיקות לכת על הפנוטיפ, וחלקן יכולות לגרום אף למוות. המוטציה יכולה לפגוע בכל אחד משלבי תהליך ביטוי הגנים כגון שעתוק, עיכוב או הפעלה ביתר של חלבונים מסוימים ועוד.
ב. ישנם סוגים רבים של רקומבינציות, המשותף לכולן הוא שהן כרוכות בהחלפה של מקטעי גנים בין כרומוזומים או בתוך אותו הכרומוזום. החלפות אלו יכולות לגרור שינויים קריטיים בפנוטיפ של האורגניזם.
ג. שינויים במספר הכורמוזומים, מה שנקרא אנופלואידיות (Aneuploidy) יכולים לגרום לשינויים מאוד גדולים בפנוטיפ, כגון בתסמונת דאון (Down syndrome) שבה יש עודף של כרומוזום 21 מה שגורם ליכולות קוגנטיביות ירודות, שינוי במבנה צורת הפנים וכדומה.
הערת המחברים- כמובן שלכל אחד מהסעיפים יש דוגמאות בספר בהן השינוי הגנוטיפי לא הוביל לשינוי פנוטיפי. שימו לב, שבשאלה נשאלנו מה ״עשוי״ להוביל לשינוי פנוטיפי ולכן כלל התשובות נכונות שכן, כל סעיף בין א׳-ג׳ יכול להוביל לשינוי בפנוטיפ האורגניזם.
להרחבה- Alberts, The Cell 7th Ed., עמ׳ 519-524
מולקולרית 5 שאלה 2
בניסוי שמבוסס על promoter deletion analysis נמצא כי מחיקה של רצף DNA גרמה לאיבוד של ביטוי גנים. כאשר אזור זה חובר באופן סינטטי לפרומוטור מינימלי וגן מדווח, וכל הרצף הזה שובט בחזרה לאורגניזם המקורי לא היה ביטוי של הגן המדווח. ניסויים אלו:
התשובה הנכונה היא ג’- ניתן להבין כי אם ביטוי של גנים מסויימים מופסק לאחר מחיקת מקטע DNA בגנום אז אותו רצף לוקח חלק בבקרה על ביטוי אותם גנים. שכן, אותו רצף יכול להיות פרומוטור לדוגמא. אולם, מאחר והרצף הזה בלבד לא היה מספיק כדי להביא לביטוי הגן המדווח, ניתן להבין כי אותו רצף איננו התנאי היחיד לביטוי אותם גנים. נניח כי אותו רצף הוא פרומוטור, במקרה כזה יתכן כי יש צורך באקטיבטור שיפעיל את הפרומוטור. שכן,פרומוטורים רבים חלשים מידי בשביל לקשור את RNA פולימראז ללא עזרה של פקטורי שעתוק והדבר תלוי בסביבה שאותו פרומוטור נמצא, כלומר, בקרבה אל רצפים מאקטבים או מעכבים. על כן, תוצאות הניסוי מראות שהרצף קריטי לביטוי גנים אך לא מספיק ותלוי ברצפים שנמצאים סביבו או בפקטורי שעתוק שונים.
שלילת מסיחים:
א. אם אזור ה-DNA שנמחק לא היה הכרחי לביטוי גנים הוא גם לא היה מספיק לביטוי הגנים, שני חלקי התשובה סותרים זה את זה. שכן, פרומוטורים חזקים לדוגמא, שלא נזקקים לעזרה של אקטיבטורים או נחסמים על ידי רפרסורים, מובילים לביטוי רציף של הגנים אותם הם מבקרים והם הגורם ההכרחי הבלעדי לביטוי אותם גנים.
ב. אם אזור ה- DNA שנמחק לא היה הכרחי לביטוי הגנים, היינו רואים המשך ביטוי של אותם גנים גם לאחר מחיקת אותו רצף. מהשיטה עצמה אנו מצפים יכולת סיווג של רצפים שרלוונטים לביטוי גנים ורצפים שאינם רלוונטים לביטוי גנים. רצפים שאינם רלוונטים לביטוי גנים לא ישפיעו על השעתוק בתא.
ד. אכן, הוכחנו כי רצף ה- DNA שנמחק הכרחי לביטוי אותם גנים. אך במסיח הזה מצויין גם כי אותו רצף מספיק לביטוי הגנים. אולם כפי שהוסבר במסיח ג’ וא’, אילו היה מספיק לביטוי אותם גנים, היינו רואים ביטוי של הגן המדווח בחלק השני של הניסוי. כנראה, שהוצאת הרצף מסביבתו הטיבעית במולקולת ה-DNA פגעה באפקט החיובי של אותו רצף על השעתוק. משמעות הדבר היא, שאותו רצף אינו מספיק לשעתוק וזקוק לרצפים נוספים או עזרה של פקטורי שעתוק.
להרחבה – Alberts, מהדורה שביעית, עמודים 423-426
מולקולרית 1 שאלה 5
הסכמה הבאה מתארת מזלג הכפלה במהלך שכפול של פרוקריוטים. מה מתואר לא נכון בסכמה?
הסבר: במה השאלה עוסקת: בועית שכפול
תשובה ד׳: האיור מדגים את הקונפורמציה שמתקבלת בעת תהליך השכפול של הכרומוזום כאשר שני הגדילים מופרדים בעזרת אנזימי הליקאז (Helicase) והתקדמותם לכיוונים מנוגדים. מבנה זה נקרא בועית השכפול (Replication bubble) אשר מורכבת משני מזלגות שכפול (Replication forks). את מבנה זה ניתן לראות בפרוקריוטים (במיקום יחיד שבו נמצא ה- Origin) ובאאוקריוטים (בכל ה-Origin שפרושים לאורך כל הכרומוזום) כאחד. נושא הכיוונים של אנזימי השכפול מאוד מבלבל ועל מנת לפשטו צריך לזכור פרט חשוב – כל סוגי הפולימראזות מסנתזות לכיוון של 5′ ל-3′ (כלומר מוסיפות נוקלאוטידים חדשים בקצה 3′ בכל פעם), ולכן הם נעות וקוראות את גדיל התבנית בכיוון ההפוך – מ-3′ לכיוון 5′. כאשר זוכרים זאת, התשובה כבר ידועה, בנוסף לזאת על מנת שהפולימראז יתחיל לסנתז הוא צריך פריימר (Primer) שממנו הפולימראז מתחיל להוסיף נוקלאוטידים לקצה 3′. ולכן בכל פעם שיש פריימר עם רצף מסוים – הפריימר יהיה בקצה ה-5′ שלו כי הפולימראז חייב להאריך את הרצף בקצה 3′. באיור שבשאלה, ניתן לראות כי הפריימרים נמצאים בקצה 3′ של הגדיל הבת (הגדיל החדש שמסונתז) ולכן זו הטעות באיור.
שלילת מסיחים:
א׳. גדיל האב (Parental strand) הם הגדילים המקוריים שעל פיהם הפולימראז מסנתז את גדילי הבת (Daughter strand), אשר נקראים גם גדילי התבנית (Templet strand). גדילים אלו מקבילים אחד לשני, כלומר קצה 3′ של גדיל אחד יהיה מקביל לקצה ה-5′ של הגדיל השני, ולכן כפי שניתן לראות באיור כיוונם של הגדילים תקין.
ב׳ מקטעי האוקזאקי (Okazaki fragments) הם המקטעים שנוצרים בגדיל המתעכב (Lagging strand) עקב הכיווניות של הפולימראז, בכל מזלג שכפול יש גדיל מתעכב אחד וגדיל מוביל אחד (Leading strand). הגדיל המוביל יהיה זה שיתקדם לעבר הכיוון שמזלג השכפול מתקדם (כלומר הפולימראז נע לאותו כיוון שההליקאז נע באותו מזלג) והגדיל המתעכב הוא הגדיל אשר מסונתז לכיוון הנוגד את התקדמות מזלג השכפול (כלומר הפולימראז “מתרחק” מההליקאז). ולכן כפי שניתן לראות המיקום של מקטעי האוקזאקי בגדיל המתעכב נכונים, אומנם המיקום של הפריימר בתוכם לא, אך הם נכונים, ולכן תשובה זו אינה הנכונה.
ג׳ שכפול חיידקי (פרוקריוטי) הוא גם שכפול דו-כיווני כמו באאוקריוטים. מספר סוגי וירוסים משכפלים בצורה חד-כיוונית (Unidirectional) את הגנום החד-גדילי שלהם (DNA או RNA), תהליך זה נקרא “Rolling circle replication”. בתהליך זה, הפולימראז מתחיל לשכפל בנקודת ה-Origin את הגנום ומבצע מספר “סיבובים” על החד-גדיל כאשר בסופו של התהליך מגיע אנדונוקלאז (Endonuclease) שמבצע חיתוך במספר מקומות בגדיל הארוך החדש למקטעי גנום קצרים יותר. שיטת שכפול זו יעילה מאוד מכיוון שהיא מהירה ומספקת מספר תוצרים בכל פעם.
להרחבה– Alberts, מהדורה שביעית, ע”מ 256-258 (DNA replication)
מולקולרית 2 שאלה 2
מהו מספר הכרומוזומים המאפיין תאי עור הומניים ותאי זרע, בהתאמה? (שים לב שסדר המספרים כתוב מימין לשמאל)?
במה השאלה עוסקת: Chromosomes.
תשובה ג‘. הכרומוזומים הם המבנים אשר מכילים את הדנ”א יחד עם החלבונים שעוטפים ואורזים אותו. כשמדברים על כרומוזומים הכוונה היא לכרומוזומים האאוקריוטים, אומנם גם בפרוקריוטים הגנים ארוזים בחלבוני אריזה מיוחדים (שאינם דומים לחלבונים האאוקריוטים) אך הם שונים לגמרי במבנם. הכרומוזום ההומני (Human chromosome) מורכב מזוגות של כרומוזומים הומולוגיים (Homologous chromosome) שבנויים מכרומוזום אימהי וכרומוזום אבהי. לאדם בתאים סומטיים (Somatic cells) יש כ-22 זוגות של כרומוזומים הומולוגיים וזוג כרומוזומי מין (Sex chromosomes), כאשר בזכר נראה כרומוזום X אחד וכרומוזום Y אחד, ובנקבה נראה שני כרומוזומי X (אחד מהאם ואחד מהאב). לעומת התאים הסומטיים שהם תאים דיפלואידים (Diploids), תאי המין מכילים רק עותק אחד מכל כרומוזום, כלומר אלו תאים הפלואידים (Haploids) שמאפיינים את תאי הזרע והביצית, והם מכילים כ-23 כרומוזומים סה”כ.
שלילת מסיחים:
א’. מכיוון שהתאים הסומטיים מכילים את הדנ”א שהגיע מהאב ומהאם, כלומר דיפלואידים, הם מכילים שני עותקים מכל כרומוזום – 23 (22 כרומוזומים רגילים + זוג כרומוזומי מין) סה”כ הכרומוזומים בתא היה 46.
ב’. כפי שנאמר מעל, תאי הנבט (Germ cells) הם תאי המין של האורגניזם, ומכיוון שהם צריכים ליצור את התא ההפלואידי כל אחד מכיל רק עותק אחד של הכומוזומים (עותק אבהי או עותק אימהי) ולכן התאים אלו נראה רק 23 כרומוזומים.
ד.. פרט למקרים אבנורמליים, תמיד תאי הנבט יכילו פחות כרומוזומים מאשר תאי סומטיים. ולכן מסיח זה אינו נכון.
להרחבה- Alberts, The Cell 7th Ed., עמ׳ 190-194
מולקולרית 4 שאלה 3
איזה מוטציה תוביל לחלבון ארוך במיוחד?
תשובה ב‘. קודוני הסיום (Stop codons) הם השלושת הנוקלאוטידים שעליהם מתחבר פקטור השחרור (Release factor) שגורם לניתוק הפוליפפטיד מהריבוזום ולסיום תהליך התרגום (Translation termination). ה-Release factors הם חלבונים שמסוגלים להתחבר לאחד מקודוני הסיום – UAA, UAG ו-UGA (אני אוהב לזכור אותם כ”או-אה”,”או-אג” ו-“עו-גה”), כאשר הם נמצאים ב-A-site של הריבוזום – האתר שעליו נכנסים ה-tRNA שטעונות בח. האמינו החדשות בכל פעם. אם יש מוטציות ובעיות שונות שפוגעות בקודון הסיום ה-Release factor לא יוכל להתחבר לריבוזום ולכן תהליך התרגום ימשיך ונקבל פוליפפטיד ארוך מהרגיל. בהקשר השאלה, כאשר תתרחש מוטציה באנטי-קודון (Anti-codon) של ה-tRNA אשר תגרום להחלפת ציטוזין (Cytosine) לאורציל (Uracil) – ריאקציה שנקראת דה-אמינציה (Deamination), האנטי-קודון UCA מסוגל כעת להתחבר לקודון הסיום UGA. יכולתו של ה-tRNA שטעון בטריפטופן (Trp) להיקשר לקודון הסיום יגרום לריבוזום להמשיך לסנתז (ישים טריפטופן במקום להפסיק את התרגום) ולכן נקבל חלבון ארוך מהרגיל.
הערת המחבר – ישנו מקרה ספציפי שבו מסוגלת מולקולת tRNA מיוחדת שטעונה בח. אמינו סלנוציסטאין (Selenocysteine) להתחבר לקודון טרמינציה (UGA), לא ידוע למה דווקא קודון ספציפי פעם משמש לסיום ופעם אחרת משמש לח. האמינו סלנוציסטאין וכיצד הריבוזום יודע להבדיל ביניהם, אך חשוב להכיר מקרה זה.
שלילת מסיחים:
א’. אין דבר כזה tRNAstop. הפקטור שמהווה כגורם העוצר את התרגום נקרא Release factor ואינו סוג של tRNA מכיוון שהוא אינו עשוי מ-rRNA אלא מח. אמינו. מה שכן, הוא אכן דומה במבנה המרחבי שלו ל-tRNA ולכן הוא מסוגל להיכנס ל-A-site של הריבוזום ולגרום לטרמינציית התרגום.
ג’. חובה להיות ערניים ולא להתבלבל, השאלה מדברת על תהליך התרגום פגום שבו נוצר חלבון ארוך מהרגיל. ולכן מוטציה בתהליך השעתוק תפגע ביצירת גדיל ה-mRNA (ותיצור גדיל ארוך מהרגיל) ולא תגרום ליצירת חלבון ארוך מהרגיל מכיוון שקודון הסיום של התרגום עדיין תקין (מכיוון שרצף הטרמינציה של השעתוק נמצא באזור הלא-מקודד של ה-mRNA – נקרא UTR (ה-Untranslated region).
ד’. הפקטור eIF-2 הוא פקטור אינציאציה של תהליך התרגום באאוקריוטים אשר מחובר ל-GTP ומתחבר ל-Initiator tRNA–methionine (בקיצור Met–tRNAi) אשר מחובר ל-P-site תת-היחידה הקטנה בריבוזום. כאשר ה-GTP שעל eIF2 מפורק ל-GDP ו-Pi הוא מתנתק מתת-היחידה הקטנה ומאפשר לתת-היחידה הגדולה להתחבר עליהלכדי יצירת הריבוזום השלם. כאשר תתרחש מוטציית Loss of function ב-eIF2 שלב האינציאציה יפגע ולכן לא תתרחש כלל יצירת הפוליפפטיד, ולכןמסיח זה אינו נכון.
להרחבה – Alberts, מהדורה שביעית, ע”מ 368-375 (Translation), ע”מ 375-376 (Selenocysteine), ע”מ 455 (UTR)
מולקולרית 2 שאלה 10
פגיעה באיזה ממנגנוני התיקון של הדנ״א, היא אחד מהגורמים המרכזיים לסרטן שד?
במה השאלה עוסקת: מחלות עקב פגיעה במנגנוני תיקון.
תשובה ג. הרבה מחלות בבני אדם קשורות לפגמים במנגנוני תיקון דנ”א.
החלבונים שהכי נקשרים לסרטן השד הם אנזימי ה-BRCA1 ו-BRCA2. אנזימים אלו פועלים במנגנון הרקומבינציה ההומולוגית, כאשר BRCA1 אחראי על בקרת השלב המקדים בעיבוד הקצוות השבורים ו-BRCA2 נקשר ל-Rad51 ומעכב אותו עד לשלב שבו צריך אותו. כמובן שפגיעה באנזימים אלו נקשרת לעוד סרטנים כגון סרטן השחלות ופרוסטטה.
שלילת מסיחים-
סעיף א׳. הספר לא מספר לנו על מחלות ספציפיות הנגרמות מפגם במנגנון זה.
סעיף ב׳. פגיעה במנגנון תיקון NER תגרום למחלת XP.
סעיף ד׳. פגיעה במנגנון תיקון BER- גם פה לא מצוינת מחלה ספציפית.
להרחבה- Alberts, מהדורה 7, עמ׳ 285
מולקולרית 5 שאלה 3
מוטציה ברצף האופרטור של אופרון הלקטוז מונעות מהרפרסור להיקשר אליו. מה נצפה לראות בחיידק הנושא מוטציה זו?
התשובה הנכונה היא ד’- הבקרה על אופרון הלקטוז היא כפולה. מצד אחד, ישנו רפרסור לאופרון. הרפרסור, lacI, קושר את אופרון הלקטוז באופן קונסטיטוטיבי עד לשחרורו על ידי אלולקטוז, משרן של lacI שנוצר כתוצר לוואי בעת פירוק לקטוז על ידי בטא לקטוזידאז. כלומר, על מנת לשחרר את העיכוב של lacI על אופרון הלקטוז דרושים רמות גבוהות של לקטוז במצע הגידול. מנגד, לאופרון הלקטוז יש גם אקטיבטור, שמעודד ביטוי של האופרון במצע גידול חסר גלוקוז. ברמות נמוכות של גלוקוז בתא, החיידק מייצר רמות גבוהות של cAMP, סמן לחסר מטבולי בתא. cAMP הוא קו אקטיבטור לאקטיבטור CAP של אופרון הלקטוז ואופרונים מטבולים רבים אחרים. משמע, ברמות נמוכות של גלוקוז, אופרון הלקטוז עובר אקטיבציה. וברמות גבוהות של לקטוז, מוסרת האינהיביציה מהאופרון. כלומר, ביטוי הגנים באופרון הוא מקסימלי בריכוזים נמוכים של גלוקוז וריכוזים גבוהים של לקטוז. נוכל למצוא בכך הגיון, החיידק מעדיף לנצל גלוקוז כמקור אנרגיה, שכן, זו מולקולת הסוכר הפשוטה ביותר, פירוקה מניב מקסימום אנרגיה ומבזבז מינימום אנרגיה. לעומת זאת, פירוק לקטוז דורש כמות גדולה יותר של אנרגיה, שכן,דרושים אינזימים ספציפים לתהליך והייצור שלהם גוזל מהתא אנרגיה רבה. כך שרק בהיעדר גלוקוז התא יפנה למטבוליטים אחרים. וכן, אין סיבה לייצר את האינזימים לפירוק לקטוז אם אין לקטוז בתא. כך שגם לנוכחות לקטוז יש משמעות לביטוי הגנים באופרון. בשאלה הנ”ל, ישנו אופרון שמכיל מוטציה באופרטור, הרצף שאליו נקשר הרפרסור. במקרה הזה, אין קשירה של הרפרסור גם בריכוזים נמוכים של לקטוז. כך האופרון פעיל יותר מאופרון ה- WT בהיעדר גלוקוז ולקטוז. מאחר ובריכוזים נמוכים של לקטוז וגלוקוז אין רפרסיה (כי הרפרסור לא פעיל), ויש אקטיבציה (כי חסר גלוקוז).
שלילת מסיחים:
א. החיידק איבד את היכולת להבחין בהבדל בין מצע חסר לקטוז למצע עשיר בלקטוז. שכן, הסנסור לכמויות הלקטוז בתא היה הרפרסור של אופרון הלקטוז. בטא לקטוזידאז אומנם האינזים שמפרק לקטוז, אך ביטויו עולה רק לאחר שהרפרסור lacI מפסיק לעכב את ביטוי הגנים באופרון. העיכוב מוסר רק בנוכחות לקטוז. מאחר והמוטציה באופרטור לא מאפשרת קשירה של הרפרסור, אין עיכוב על האופרון והתא מבטא את הגנים ללא קשר להרכב הלקטוז במצע הגידול. כלומר, החיידק דווקא יגדל מעולה על מצע שמכיל לקטוז כמקור סוכר יחיד.
ב. לא נכון, בנוכחות גלוקוז, לא תיהיה אקטיבציה על האופרון ורמות הביטוי של הגנים באופרון הלקטוז יהיו מעט נמוכות יותר כמו ברמות נמוכות של גלוקוז. המוטציה הובילה לכך שאין משמעות לרמות הלקטוז במצע, אך רמות הגלוקוז עדין משפיעות על רמות הביטוי של אופרון הלקטוז. כפי שהוסבר במסיח ד’, לאופרון הלקטוז 3 רמות ביטוי במצב התקין (ללא מוטציות). האחת, בריכוז גבוה של גלוקוז (אין אקטיבציה) וריכוז נמוך של לקטוז (יש רפרסיה), ביטוי הגנים מינימלי. השנייה, בריכוז נמוך של גלוקוז ולקטוז (יש אקטיבציה, יש רפרסיה), או ריכוז גבוה של גלוקוז ולקטוז (אין אקטיבציה, אין רפרסיה), ביטוי הגנים בינוני. ואילו השלישית, בריכוז נמוך של גלוקוז (יש אקטיבציה) וריכוז גבוה של לקטוז (אין רפרסיה), ביטוי הגנים מקסימלי.
ג. רמות ה- cAMP קשורות לחישת רמות הגלוקוז בתא. מוטציה באופרטור, קשורה לחישת רמות הלקטוז בתא. משמע, לא תיהיה השפעה על רמות ה- cAMP בתא, שכן, המוטציה באופרטור לא משפיעה כלל על רמות הגלוקוז בתא ועל התגובה של התאלרמות האלו. ישנה השפעה על יכולת התא לחוש את רמות הלקטוז בתא, אבל גם זה לא משפיע על הרמות בפועל.
להרחבה – Alberts, מהדורה שביעית, עמודים 412-414
שאלה כלשהי
הסבר לפיתרון
חשוב לזכור
מולקולרית 2 שאלה 4
מה מהבאים נכון לגבי שיטת CRE/LOX?
במה השאלה עוסקת: Cre\LoxP.
תשובה ד. שיטת Cre\LoxP שהתגלתה לראשונה בבקטריופאג׳P1, היא שיטה חשובה בהנדסה גנטית שבה ניתן לבצע שינויים בגן מסוים כגון מחיקות, הכנסות, היפוכים וכדומה. בשיטה זו, יש אנזים מיוחד מסוג רקומבינאז (Recombinase) שנקרא Cre אשר מסוגל לחתוך רצפי LoxP. לכן רק כאשר שני אלו נמצאים יחדיו ניתן לבצע מניפולציות שונות על גנים.
שלילת מסיחים:
א. כפי שנאמר מעל, ה-LoxP הוא הרצף/האתר שבו חותך האנזים Cre. חשוב לזכור כי האנזים חייב 2 אתרי LoxP בשני צדדי גן המטרה על מנת שיוכל לחתוך אותו כראוי.
ב. CRE הוא האנזים בעצם. אומנם בשיטה זו כן מכניסים את הגן שלו יחד עם הפרומוטר שלו, אך הוא ללא ספק אינו מהווה פרומוטר ל-LoxP שכן האחרון אינו רצף שבא לידי ביטוי אלא משמש כאתר מטרה לאנזים Cre בלבד.
ג. בדיוק להיפך.
להרחבה-Alberts, מהדורה 7, עמ’ 316-317 (Cre-LoxP).
מולקולרית 1 שאלה 21
מולקולות DNA בודדה מתא הומני ונמצא שהיא מכילה 20% מהנוקלאוטיד גואנין. מה אחוז הנוקלאוטיד אדנין במולקולה?
תשובה נכונה- ב׳. על פי זיווג בסיסים, G=20%, C=20%. נשאר 60 אחוז שמתחלקים שווה בשווה בין A ל – T , כל אחד 30 אחוז. ניתן לפסול את ד’ משום שנתון תא הומני, דהיינו סליל כפול של DNA בו מתקיימים זיווגי בסיסים. תשובה זו הייתה נכונה לו היה נתון גדיל בודד.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 185-186
מולקולרית 2 שאלה 6
לאיזה מהחלבונים הבאים, וירוס הקורונה מקודד בגנום שלו?
במה עוסקת השאלה- וירוס הקורונה
התשובה הנכונה- ג׳
הסבר: וירוס הוקורנה הוא וירוס RNA. כל שהוא צריך כדי לשכפל את עצמו זה רנ״א פולימראז נגיפי שהוא מקודד אליו בעצמו. הוא משתמש בריבוזום התאי בתהליך התרגום. אין לו שלב של DNA ולכן תשובה ב׳ לא נכונה או רלוונטית. סעיף ד׳ מתייחס לרטרווירוסים ולא לוירוסי רנ״א. לוירוס הקורונה אין שלב של DNA במחזור החיים שלו.
להרחבה- Alberts, מהדורה 7, עמ׳ 311-313
מולקולרית 1 שאלה 8
כיצד כלל התאים מאכסנים את המידע הגנטי שלהם?
התשובה הנכונה- ב׳. הסבר: זו דוגמה לשאלה של משפט הלקוח מכותרת כחולה בספר וזה פשוט מה שכתוב. בחלק זה, הספר מסביר לנו שבניגוד למה שאנחנו עלולים לחשוב, כלל היצורים החיים היום מאחסנים את המידע הגנטי שלהם בצורה של דנ״א דו-גדילי. שימו לב- הכוונה היא ליצורים חיים ולכן אין התייחסות לוירוסים שכמובן בעלי סוגים שונים של גנומים.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 2-3
מולקולרית 1 שאלה 25
איזה מהמשפטים הבאים מסביר בצורה הטובה ביותר מדוע, בעופות וביונקים, אשכולות הגלובין מסוג α ו־β נמצאים על כרומוזומים שונים, בעוד שאצל דו־חיים הם מופיעים על אותו כרומוזום?
התשובה הנכונה- ב׳. משפחת גני הגלובין מספקת דוגמה מצוינת לאופן שבו הכפלת DNA יוצרת חלבונים חדשים, וההיסטוריה האבולוציונית שלה נחקרה בצורה יסודית במיוחד. הדמיון החד-משמעי בהרכב חומצות האמינו ובמבנה בין הגלובינים המודרניים מרמז על כך שכולם התפתחו מאותו גן אב קדמון משותף, גם אם כעת חלקם מקודדים ע״י גנים המרוחקים זה מזה בגנום של יונקים. אצל הדו־חיים לדוגמה, הצפרדע (Xenopus) אשכולות ה־α־גלובין וה־β־גלובין נמצאים על אותו כרומוזום. לעומת זאת, בעופות וביונקים הם על כרומוזומים נפרדים. הסיבה לכך היא, אירוע טרנסלוקציה כרומוזומלית שהתרחש אחרי שהשושלת של העופות והיונקים נפרדה מזו של הדו־חיים, וכתוצאה מכך הופרדו האשכולות לשני כרומוזומים שונים.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 241-242
מולקולרית 2 שאלה 7
מה תפקידו של האנזים טרנספוזאז?
במה השאלה עוסקת: Transposase.
תשובה ג. אנזים המפתח בתהליך הטרנספוזיציה (Transposition) הוא הטרנספוזאז (Transposase), אנזים זה מסוגל להתחבר ל-Inverted repeats בקצוות הטרנספוזון (Transposon), שנקראים גם אלמנטים מוביילים (Transposable elements) ולקרב ביניהם מבחינה מרחבית ע”י יצירת Loop בדנ”א וכך לנתקם מהגנום והעברתם למיקום רנדומלי אחר. כמובן שגם פעולת החדרת הטרנספוזון נעשית ע”י האנזים. הטרנספוזאז פועל בטרנספוזונים מסוג DNA-only transposons .
שלילת מסיחים:
א. כפי שנאמר מעל, תפקידו של ה-Transposase הוא אכן לזהות את ה-Inverted repeats אך רצפים אלו אינם ממוקמים במרכז הטרנספוזון אלא בשני קצוותיו. ולכן מסיח זה אינו נכון.
ב. הטרנספוזאז אכן יוצר חיתוך מדורג (Staggered cuts), אבל הוא יוצר אותם ברצף המטרה אליו יכניס את האלמנט המובילי ולא במיקום ממנו יוצא האלמנט. יצירת ה-Staggered cuts מאפשרת הכנסה וחיבור יותר יעילים של הרטנספוזון, כמובן שפעולה זו מצריכה סיוע של DNA polymerase ו-Ligase אשר ישלימו את הנוקלאוטידים החסרים ויחברו את הקצוות, בהתאמה.
ד. הטרנספוזאז הוא אנזים אשר מעביר רצפי DNA, הוא אינו סוג של פולימראז ולכן איננו מסוגל להשלים Gaps בכלל. לפעילותו זו תמיד נדרש דנ״א פולימראז. ה-DNA gaps נוצרים באתר החדש שבו מוכנס הטרנספוזון עקב צורת החיתוך של הטרנספוזאז.
להרחבה- Alberts, מהדורה 7, עמ׳ 307-310
מולקולרית 4 שאלה 7
איזה מהקודונים הבאים יזוהה על ידי האנטיקודון UAC?
תשובה ד‘. ה-Wobble effect או Wobble base-pair היא תופעה שבה הצימוד בסיסים (Base pair) בין הנוקלאוטיד השלישי בקודון (Codon) לבין הנוקלטוטיד הראשון באנטי קודון (Anti-codon), לא מתקיים רק לפי ווטסון וקריק. הקשר בעמדה זו יכול להיות מתירני ורופף יותר, ומאפשר צימוד בין זוגות לא קונבנציונלים של נוקלאוטידים. כאשר ניגשים לפתור שאלה כזו, חשוב לזכור שקריאת הקודונים היא משמאל לימין, כאשר השמאלי ביותר יהיה קצה 5′ והנוקלאוטיד בקצה הימיני ביותר יש קצה 3′. בנוסף, חשוב לשים לב שהאנטי-קודון (שהיא אחת הזרועות של ה-tRNA) מתחברת ל-Codon ב-mRNA בצורה של מהופכת של Anti-parallel– כלומר קצה 5′ מתחבר לקצה 3′. תופעת Wobble מאפשרת לקודון השלישי (בקצה 3′ של ה-mRNA) להתחבר לנוקלאוטידים שונים באנטי-קודון, ניתן לראות בתמונה את האפשרויות הקיימות:
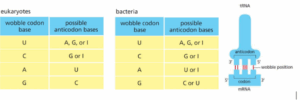
כפי שניתן לראות, בתשובה ד’ יש G בקצה 5′ שמסוגל להתחבר ל-C בקצה ה-3′ של האנטי-קודון, ו-G בעמדה 3′ שמסוגל להתחבר ל-U בקצה 5′ של ה-tRNA (=וובל). ולכן תשובה זו הנכונה.
שלילת מסיחים:
א’. כזכור, הקודון AUG הוא הקודון היחיד שמסוגל לקודד לח. האמינו מתיונין (Methionine), אשר משמש בנוסף כקודון ההתחלה (Start codon) שאליו התחבר ה-Initiator tRNA המיוחד – בפרוקריוטים זה יהיה מתיונין שמחובר אליו קבוצת פורמיל (Formyl-methionine). ה-C שבקצה 3′ של האנטי-קודון אינו מסוגל להתחבר ל-G של הקודון בקצה 5′ ולכן מסיח זה אינו נכון.
ב’. גם במקרה זה ה-C שבקצה 3′ של האנטי-קודון אינו מסוגל להתחבר ל-G של הקודון בקצה 5′ ולכן מסיח זה אינו נכון. חשוב לא להתבלבל בין קצה 3′ לקצה 5′.
ג’. אינוסין (Inosine) הוא נוקלאוטיד מיוחד אשר נוצר כאשר הבסיס החנקני Hypoxanthine מתחבר לבסיס הסוכרי ריבוז (Ribose). האינוסין יכול להיווצר עקב תהליכי דה-אמינציה (Deamination) של אדנין (Adenine) ספונטניים או ע”י אנזים מיוחד שנקרא A-to-I editing enzyme (בקיצור ADAR). את האינוסין רואים בעיקר במולקולות ה-tRNA (ניתן לזכור זאת עקב הבסיס הריבוזי שלו ולאהדיאוקסי-ריבוז שבדנ”א).
להרחבה – Alberts, מהדורה שביעית, ע”מ 360 (Wobble), ע”מ 358-360, ע”מ 291-292 (Hypoxanthine), ע”מ 337 (Inosine) וע”מ 451 (ADAR).
מולקולרית 4 שאלה 11
מה לא נכון בנוגע לריבוזום?
תשובה ג’. הריבוזום (Ribosome) הוא קומפלקס מיוחד אשר מבצע את פעולת התרגום (Translation) של גדילי ה-mRNA בכלל האורגניזמים השונים. קומפלקס זה הוא סוג של ריבונוקלאופרוטאין אשר מורכב הן מחלבונים והן מחומצות גרעין אשר נחלק ל-2 תתי-יחידות עיקריות: גדולה וקטנה. באאוקריוטים הגדולה נקראת 60S (לפי מקדם השקיעה שלה – Sedimentation coefficient) והקטנה 40S. וכן בפרוקריוטים יש את ה-50S וה-30S, בהתאמה. לריבוזום יש 3 אתרים (Sites) עיקריים שמאפשרים את תהליך התרגום. הראשון נקרא A-site ואליו נכנס ה-Aminoacyl-tRNA (ומכאן שמו), השני P-site שבו מתרחש פעולת יצירת הקשר הפפטידי (ע”י האנזים Peptidyl transferase שנמצא בתת-היחידה 28S או 23S) כלומר באתר זה תהיה המולקולה Peptidyl-tRNA, ובאתר האחרון שנקרא E-site ה-tRNA הריק יוצא (Exit). תתי-היחידות של הריבוזום אכן מקודדות ע”י אותו ה-RNA polymerase בפרוקריוטים (מכיוון שקיים רק רנ”א פולימראז אחד בהם שמסוגל לקודד את כל סוגיה-RNA), אך באאוקריוטים, ישנם מספר RNA polymerases שמשתתפות בייצורו של הריבוזום, דבר ראשון ה-RNA polymerase II אשר אחראי לייצור החלבונים שלו וכן ה-RNA polymerase I שאחראי לייצור הרוב ה-rRNA שבונים אותו. בנוסף, גם הרנ”א פולימראז 3 תורם חלק קטן מהריבוזום ע”י ייצור ה-5S rRNA שמהווה כחלק מתת-היחידה הגדולה (60S), ולכן מסיח זה אינו נכון ואותו נסמן.
שלילת מסיחים:
א’. כפי שנאמר מעל, אכן ה-40S וה-30S הן תתי-היחידות הקטנות שלא האאוקריוטים והפרוקריוטים, בהתאמה. כמו כן, חשוב להכיר שה-40S מורכבת מ-rRNA של 18S וה-30S מ-16S (שמהווה כרצף התחברות ל-Shine–Dalgarno sequence).
ב’. לריבוזום יש כ-4 אתרי קשירהלגדילי RNA, ישנם את שלושת האתרים העיקריים שתוארו מעל:ה-A-site, P-site וה-E-site (שקושרים tRNA) ויש את אתר הקשירה ל-mRNA שנקרא מן הסתם mRNA binding site.
ד’. נכון. תת-היחידה הקטנה מתחברת ראשונה לגדיל ה-mRNA בשלב האינציאציה של התרגום (Translation initiation).
להרחבה– Alberts, מהדורה שביעית, עמ’ 365-368 (Ribosome) ועמ’ 369-371 (Translation).
מולקולרית 4 שאלה 23
מה הוא UTR?
תשובה ד‘. ה-UTR הם רצפים ב-mRNA אשר לא עוברים תרגום (Untranslated regions). ישנו רצף 5’UTR שנמצא בין ה-5′-Cap לבין האזור המקודד (Coding region) ויש 3’UTR שנמצא בין סוף האזור המקודד לזנב ה-Poly-A. לאזורים אלו תפקידים רבים, אחד מהם הוא רגולציית תרגום ה-mRNA, מכיוון שהם עשויים להכיל את הריבוסוויץ (Riboswitch), אתרי קישור ל-miRNA, אתרי IRES וכו’. מכיוון שאזורים אלו לאחר השעתוק (Transcription) עוברים שחבור (Splicing) ויוצאים מהגרעין הם נחשבים אקסונים (Exons) ולכן תשובה זו נכונה.
שלילת מסיחים:
א’. ה-Spliceosome הוא קומפלקס חלבון + RNA (מסוג snRNA) אשר אחראי על תהליך השחבור (Splicing). קומפלקס זה בנוי בעיקר מחלבונים ומ-5 סוגים של snRNA שנקראים U1, U2, U4, U5 ו-U6. כפי שהוסבר מעל, ה-UTR לא קשור לקומפלקס זה ולכן מסיח זה אינו נכון.
ב’. ה-UTR קיים הן בפרוקריוטים והן באאוקריוטים ולכן מסיח זה לא נכון.
ג’. כפי שנאמר מעל, ה-Open reading frame (בקיצור ORF) נתחם ע”י 2 ה-UTR וכמובן שהוא אינו עובר תרגום כלל.
להרחבה – Alberts, מהדורה שביעית, עמ’ 453-456 (UTR) ועמ’ 341-344 (Spliceosome).
מולקולרית 1 שאלה 7
איפה וכיצד מסונתזים מקטעי אוקזאקי (Okazaki fragments)?
במה השאלה עוסקת: Okazaki fragments.
תשובה ג. מקטעי אוקזאקי (Okazaki fragments) מתארים את קטעי ה-DNA שסונתזו במהלך תהליך השכפול (Replication) בגדיל המתעכב (Lagging strand). מקטעים אלו אינם רצפים, זאת לעומת המקטע הארוך שמסונתז בגדיל המוביל (Leading strand) מכיוון שהכיווניות של הגדיל המתעכב הפוכה לכיוון התקדמות מזלג השכפול (לחילופין, מנוגדת לכיוון תנועתו של האנזים Helicase) ולכן היא מתקדמת במקטעים (בכל פעם ההליקאז חופש עוד אזור שמתחיל להיות מסונתז וכן הלאה). מקטעים אלו נמצאים גם בפרוקריוטים (באורך של 1000-2000 נוקלאוטידים) וגם באאוקריוטים (באורכים של 100-200 נוקלאוטידים). כמובן שמקטעי אלו מסונתזים מקצה 5′ לקצה 3′ מכיוון שהפולימראזות (כל סוגי הפולימראזות ללא יוצא מן הכלל!) מסנתזות מכיוון 5′ ל-3′.
הערת המחבר – אחד ההסברים המעניינים להבדל שבין אורכי מקטעי האוקזאקי בפרוקריוטים לאאוקריוטים נעוץ בנוכחותם של הנוקלאוזומים (Nucleosomes) שאחראיים לדחיסת הגנום האאוקריוטי אשר נמצאים במרווחים של 200 נוקלאוטידים לאורך הכרומוזום. כאשר הדנ”א פולימראז דלתאDNA (polymerase δ) שאחראי על סינתזת הגדיל המתעכב מגיע לנוקלאוזום הוא נעצר ולכן אינו מסוגל להמשיך.
שלילת מסיחים:
א . בגדיל המוביל לא יווצר מקטעי אוקזאקי מכיוון שהוא המשכי והדנ”א פולימראז “רץ” עליו ללא הרבה עצירות ולכן אינו מכיל מקטעים קצרים. זה נובע מהסנכרון בכיוון תנועתם של הפולימראז וההליקאז (כלומר הפולימראז עם כיוון פתיחת מזלג השכפול).
ב . בהמשך לנ”ל, מקטעי האוקזאקי (וכן שום סינתזת DNA או RNA) אינה יכולה להתרחש מכיוון 3′ ל-5′ (כלומר שסנתזת נוקלאוטידים חדשים בקצה 5′ בכל פעם), זאת עקב יכולתו של הפולימראז לסנתז רק בכיוון 5′ ל-3′.
ד .כאשר מבינים את כיוון פעולת הפולימראזות, חשוב לא להתבלבל או למהר במסיחים כאלו, ולשים לב לא ליפול במסיחים כאלו שבאים להטעות. אם הכיווניות מבלבלת מעט, אפשר פשוט להשקיע כמה שניות ולצייר זאת על מנת להיות בטוחים.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 260-261
מולקולרית 4 שאלה 10
לפניך תגובות המתרחשות במהלך הטענת tRNA, אותן מזרז האנזים אמינו-אציל-tRNA-סינתטאז. איזה מהמסיחים מתאר נכונה את הקשר בין התגובות?
- amino acid + ATP-> aminoacyl-AMP+PPi
- amino acid + ATP+ tRNA-> aminoacyl-tRNA+AMP+PPi
- amino acyl-AMP + tRNA-> aminoacyl-tRNA+AMP
תשובה ב‘. בשביל לענות על השאלה, עלינו להכיר את שני שלבי ראקציית ההטענה שמתבצעים על ידי האנזים אמינואציל tRNA סינתתאז (Aminoacyl tRNA synthetase). בשלב הראשון, האנזים מאקטב את החומצה האמינית ע”י AMP מ-ATP, תוך שיחרור פירופוספט (Pyro-phosphate). בשלב הבא, האנרגיה האגורה בקשר אמינואציל-AMP משמשת להעברת החומצה האמינית ל-tRNA המתאים, כך שמקבלים אמינואציל-tRNA. באנזים קיימים 3 אתרים במרכזיים:
1) אתר קישור לח. האמינו.
2) אתר קישור ל-AMP.
3) אתר קישור ל-tRNA.
בראקציה המלאה משתמשים בחומצה אמינית אחת, tRNA מתאים ובמולקולת ATP אחת, ששוות ערך לשתי מולקולות אנרגיה, עקב שיחרורו של הפירופוספט לתמיסה. בנוסף לפירופוספט, משתחרר בסופו של דבר גם ה-AMP ששימש לאיקטוב החומצה האמינית, ומקבלים tRNA טעון שישמש בבניית פפטידים חדשים בתא.
להרחבה– Alberts, מהדורה שביעית, ע”מ 361-363 (tRNA charge).
מולקולרית 1 שאלה 22
איזה מהתהליכים הבאים לא דורש השקעת אנרגיה?
תשובה ד‘. פעילות ה-Proofreading של הדנ”א פולימראז (DNA polymerase) היא יכולתו לתקן טעויות של זיווגי בסיסים שגויים שהוא עושה. לפי הערכות הפולימראז מבצע בממוצע כטעות זיווג אחת לכל 10^10 נוקלאוטידים, ובזכות יכולת ה-Proofreading מספר זה אף גבוה יותר. יכולת זו היא פעילות אקסונוקלאזית מכיוון 3′ ל-5′ (3′ to 5′ exonuclease), כלומר היא מבצעת חיתוך הידרוליטי (Hydrolytic), כלומר ע”י מולקולת מים, לנוקלאוטיד האחרון בקצה הגדיל. ולכן ביצוע ה-Proofreading איננו דורש שום מטבע אנרגיה.
שלילת מסיחים:
א’. החלבון DnaB הוא ההליקאז (Helicase) הפרוקריוטי אשר פועל בתהליך השכפול (Replication). הוא בנוי מ-6 תתי-יחידות זהות שכל אחת מהן מסוגלת להשתמש במולקולת ATP על מנת לנוע הדנ”א ולהפריד אותו לשניחד-גדילים נפרדים.
ב’. כשהדנ”א נפתח במזלג ההכפלה, נוצרים פיתולי על חיוביים קדימה למזלג ההכפלה, ופיתולי על שליליים אחורה למזלג. את פיתולי העל מתירים אנזימים ממשפחת הטופואיזומראזות. טופואיזומראז מסוג 1 (Topoisomerase I) – מבצע ניק בגדיל יחיד ואינו דורש ATP. טופואיזומראז מסוג 2 (Topoisomerase II) – מבצע שבר דו גדילי ודורש 2 מולקולות ATP. תשובה ד’ יותר מדוייקת ולכן היא התשובה הנכונה.
ג’. מסיח מעט מבלבל כי במחשבה ראשונה כאשר הדנ”א פולימראז מחליף את הפריימר (Primer) של ה-RNA הוא איננו משתמש ב-ATP, אך צריך לזכור שגם DNA ligase פועל לאחר מכן והוא משתמש ב- ATP ולכן פעילות החלפת הפריימרים אכן דורשת אנרגיה.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 274, 269-270, 259-261
מולקולרית 2 שאלה 1
מה מהבאים עשוי להביא לשינויים בתכונות האורגניזם?
במה השאלה עוסקת: Phenotype & Genotype.
תשובה ד . זו שאלה מאוד כללית, שחשוב לדקדק ולהבין את המשמעות של כל תהליך מבחינת הגנוטיפ והשלכות שלהן מבחינה פנוטיפית . כמעט כל שינוי מבחינה גנוטיפית בגנום יגרור שינוי כלשהו, גם עם המינורי ביותר, בפעילות התא ועקב כך לשינוי כלשהו בתכונות האורגניזם (הפנוטיפ שלו). פעמים רבות לא ניתן לדעת את ההשפעה של שינוי כלשהו על האורגניזם עקב מורכבות תהליך ביטוי הגנים. דוגמה נפוצה לשינוי שאינו כרוך בהשפעה על הפנוטיפ נמצא במוטציות שקטות (Silentmutations) שבהן יש שינוי בנוקלאוטיד מסוים שאינו גורר שינוי בקודון עצמו, כלומר הוא מקודד לאותה ח. אמינו ולכן לא יהיה שינוי בחלבון.
שלילת מסיחים:
א. למוטציות גנטיות, אפילו הקטנות ביותר, יכולות להיות השפעות מרחיקות לכת על הפנוטיפ, וחלקן יכולות לגרום אף למוות. המוטציה יכולה לפגוע בכל אחד משלבי תהליך ביטוי הגנים כגון שעתוק, עיכוב או הפעלה ביתר של חלבונים מסוימים ועוד.
ב. ישנם סוגים רבים של רקומבינציות, המשותף לכולן הוא שהן כרוכות בהחלפה של מקטעי גנים בין כרומוזומים או בתוך אותו הכרומוזום. החלפות אלו יכולות לגרור שינויים קריטיים בפנוטיפ של האורגניזם.
ג. שינויים במספר הכורמוזומים, מה שנקרא אנופלואידיות (Aneuploidy) יכולים לגרום לשינויים מאוד גדולים בפנוטיפ, כגון בתסמונת דאון (Down syndrome) שבה יש עודף של כרומוזום 21 מה שגורם ליכולות קוגנטיביות ירודות, שינוי במבנה צורת הפנים וכדומה.
הערת המחברים- כמובן שלכל אחד מהסעיפים יש דוגמאות בספר בהן השינוי הגנוטיפי לא הוביל לשינוי פנוטיפי. שימו לב, שבשאלה נשאלנו מה ״עשוי״ להוביל לשינוי פנוטיפי ולכן כלל התשובות נכונות שכן, כל סעיף בין א׳-ג׳ יכול להוביל לשינוי בפנוטיפ האורגניזם.
להרחבה- Alberts, The Cell 7th Ed., עמ׳ 519-524
נושא: מולקולרית 2 תת נושא: נזקי דנ״א ומנגנוני תיקון, מוטציות, תת תת נושא: מוטציות ונזקי דנ״א-הקדמה
שם הספר: Alberts מהדורה- 7 פרק- 8
מולקולרית 4 שאלה 1
באדם ישנם 3 קודוני סיום (stop codon) ידועים. מי מהבאים אינו קודון עצירה באדם?
תשובה א‘. הקוד הגנטי (Genetic code) מתאר את הקומבינציה של 3 נוקלאוטידים ב-mRNA אשר כל אחד מכונה קודון (Codon). כל קודון מקודד לח. אמינו מסוימת. ישנו קודון אחד שמשמש כקודון התחלה (Start codon) שהוא AUG. קודון זה מקודד לח. האמינו מתיונין (Methionine) הן באאוקריוטים והן בפרוקריוטים, כאשר באחרונים מחוברת אליו קבוצת פורמיל (Formyl). וכן ישנם 3 קודונים אשר לא מקודדים לח. אמינו אלא לחלבון שנקרא פקטור שחרור (Release factor) שתפקידו להפסיק את קידוד ה-mRNA, קודונים אלו הם UAA, UAG ו-UGA. אני אוהב לזכור אותם לפי המשפט: “או-אה”,”או-אג” ו-“עו-גה”.
UGG מקודד לחומצת אמינו טריפטופן ומכיוון שזהו הקוד היחיד לחומצה אמינו זו מומלץ לזכור
להרחבה – Alberts, מהדורה שביעית, עמ’ 374-375 (Stop codons) ועמוד 359 (Genetic code).
מולקולרית 2 שאלה 13
איזה מהחלבונים הבאים לא יופעל בעת תיקון שבר דו-גדילי בדנ״א?
במה השאלה עוסקת: תיקון שברי דנ”א.
תשובה א׳. SeqA הוא חלבון אינהיבטורי (Inhibitor protein) אשר אחראי על מניעת קשירת חלבוני איניציאציה (Initiation proteins) למוצא השכפול החיידקי. בעקבות חסימה זו, אין אפשרות להתחלה של שכפול חדש לפני ששני גדילי הדנ”א ימותלו (Methylation) ברצפי GATC .
כזכור, לחיידקים יש מוצא שכפול בשם Ori-C, אשר אליו נקשר DNA-A בעל פעילות ATPase ואחראי על פרימה ראשונית של הגדיל. לאחר מכן מגיעים ה-DNA-C שנושאים את ההליקאזות (Helicase) החיידקיות- DNA-B, מטעינים אותם על אחד הגדילים (מוביל-Leading ומתעכב-Lagging) ואז עוזבים. כדי להבדיל בין הגדיל ההורי (Parental strand), כלומר הגדיל המקורי, לבין הגדיל החדש, הגדיל ההורי ממותל על גבי רצף של כ-11 רצפי נוקלאוטידים חוזרניים של GATCֿ כדי למנוע שכפול נוסף תוך כדי התרחשות של שכפול אחר, רק כאשר שני הגדילים יעברו מתילציה, ע”י אנזים בשם- Dam methylase, יפתח מוצא שכפול חדש.
שלילת מסיחים:
ב. כאשר יש נזק של שבירת הדו-גדיל של הדנ”א, חלבון ה-ATM מזרחן את הקינאזות Chk1+2 שבתורן מזרחנות את הפקטור שעתוק P53. פקטור שעתוק זה יכול לעצור את מחזור התא (Cell cycle) בעזרת הפעלת החלבון האינהיבטורי P21 או לגרום לאפופטוזיס (Apoptosis).
ג. בתיקון של שברי דנ”א דו גדיליים בשיטת ה-Homologous recombination, ישנה פלישת אחד הגדילים של כרומטידה אחות (Sister chromatid) אחת לכרומטידה אחות אחרת. המטרה- למצוא רצף של לפחות 15 נוקלאוטידים מתאימים, כך שיהיה אפשר להשלים את המידע מהשבר שהלך לאיבוד מהכרומטידת אחות. מי שאחראי לפלישת הגדיל הוא חלבון בשם Rad51, ביוקריוטים ו-RecA בפרוקריוטים. חלבון זה משתמש בהידרוליזה (Hydrolysis) של ATP על מנת להתנתק מהגדילים שמצא.
ד . קומפלקס הטרודימרי (Heterodimer) אנזימטי אשר אחראי על רוב תיקוני השברי דנ”א. עובד בשיטה של Nonhomologous end joining – . הקומפלקס מסיר נוקלאוטידים מהגדילים על מנת ליצור מצב בו נמצאת התאמה בין גדילי הדנ”א. בכך הוא גורם ל”צלקות”, מעין חוסרים במקטעי הדנ”א המתוקנים.
להרחבה- Alberts, מהדורה 7, עמ׳ 274, 298-299, 294-296
מולקולרית 1 שאלה 14
מה נכון לגבי הגנום האאוקריוטי?
התשובה הכונה- ב׳.
עוד דוגמה לשאלה הלקוחה מכותרת כחולה. למידע הגנטי של תאים איאוקריוטיים יש מוצא משולב- מארכאון אנאירובי קדום ומחיידקים שאותם אימצו התאים (התיאוריה האנדוסימביוטית). רוב המידע הגנטי הזה מאוחסן בגרעין, אך כמות קטנה נשארת בתוך האברונים שהתפתחו מהחיידקים שנלכדו- המיטוכונדריה ובתאי צמחים ואצות גם בכלורופלסטים. כאשר מפרידים את ה-DNA המיטוכונדריאלי ואת ה-DNA הכלורופלסטי מה-DNA הגרעיני ומרצפים אותם בנפרד, מגלים שהגנומים המיטוכונדריאלי והכלורופלסטי הם גרסאות מצומצמות של הגנומים החיידקיים המקוריים: בתא אנושי, למשל, הגנום המיטוכונדריאלי מורכב מ-16,569 זוגות נוקלאוטידים בלבד, והוא מקודד 13 חלבונים ומערך של 24 מולקולות RNA המעורבות בסינתזת חלבונים.
גנים רבים החסרים במיטוכונדריה ובכלורופלסטים לא נעלמו לגמרי; במקום זאת, הם עברו מהגנום של האנדוסימביוטים אל תוך ה-DNA שבגרעין התא המארח. כך, ב-DNA הגרעיני של בעלי חיים יש גנים רבים המקודדים לחלבונים החיוניים לתפקוד המיטוכונדריה, ואילו בצמחים ובאצות מצויים גנים רבים ב-DNA הגרעיני המקודדים לחלבונים הנחוצים לתפקוד הכלורופלסטים. בשני המקרים, רצפי ה-DNA של הגנים הגרעיניים הללו עדיין מציגים עדויות ברורות למוצאם החיידקי.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 27-29.
מולקולרית 1 שאלה 1
במהלך הרפליקציה, האנזים האחראי על פירוק זיווג בסיסים (Base- Pairing) בין שני גדילי ה- DNA, ואינו מבצע פירוק קשרים נוסף הוא:
הסבר: במה השאלה עוסקת: אנזימים בתהליך השכפול.
תשובה ג’. האנזים הליקאז (Helicase) מבצע פירוק של קשרי מימן מסוג Base-pairs אשר נמצאים בין נוקלאוטידים מקבילים ב-DNA. כלומר, הוא “פותח” את מבנה ה-Double helix של הדנ”א ומאפשר את היפרדות הדו-גדילים לשני חד-גדילים. בכללי, ה-DNA helicase בנויים בצורת טבעת הקסמרית מ-6 תתי-יחידות זהות שכל אחת מהן פועלת כ-ATPase אשר משמש לשינוי קונפורמציה בתת-היחידה שגורם לתנועת האנזים על גדיל ה-DNA. בפרוקריוטים ההליקאז (שנקרא DnaB) נע על הגדיל מכיוון 5′ ל-3′ שבמהלך השכפול (Replication) גדיל זה נקרא הגדיל המתעכב (Lagging strand). כמו כן, באאוקריוטים ההליקאז (שנקרא Mcm) נע בכיוון 3′ ל-5′ שמתפקד כגדיל המוביל (Leading strand). ההליקאז פועל לא רק בתהליך השכפול אלא גם בתהליכים רבים נוספים כגון בתהליכי תיקון דנ”א רבים (DNA repair), ברקומבינציה הומולוגית (Homologous recombination) כ-RuvB ובתהליך השעתוק (Transcription) כחלק מפקטור השעתוק TFIIH.
שלילת מסיחים:
א’. אקסונוקלאז הינו אנזים, ולעיתים חלק מאנזים, אשר מפרק את הקשרים בין הנוקלאוטידים שבתוך גדיל הדנ”א. קשרים אלו הם קשרים קוולנטים מסוג פוספודיאסטר (Phosphodiester) אשר נמצאים בין הבסיסים החנקניים של אותו חד-גדיל. אקסונוקלאזים מסוג 3′ ל-5′ ,אשר נמצאים על ה-DNA polymerase למשל, משמשים כחלק ממנגנון ה-Proofreading שלו לתיקון טעויות זיווגי בסיסים שהתרחשו במהלך תהליך השכפול. אנזימים אלו אינם מפרקים קשרי מימן מסוג Base-pairs ולכן תשובה זו אינה נכונה.
ב’. כפי נאמר מעל, אקסונוקלאזות מפרקות קשרים קוולנטים מסוג פוספודיאסטר, גם אקסונוקלאזות מסוג 5′ ל-3′ אשר נמצאות למשל על זנב ה-RNA polymerase ומשמשות לפירוק גדיל הרנ”א שמסונתז לאחר שעתוק רצף הטרמינציה עד לסיום פעילותו של ה-RNA polymerase, אינן מפרקות קשרי Base pair ולכן תשובה זו אינה נכונה גם כן.
ד’. האנזים גיראז (Gyrase) הוא אנזים פרוקריוטי מסוג Topoisomerase type II אשר יוצר פיתולים שליליים (Negative supercoil) בדנ”א. אנזים זה משתמש בשני ATP על מנת ליצור שני שברים בגדיל ה-DNA, הקשרים שגיראז שובר הם גם קשרים קוולנטים מסוג פוספודיאסטר (כמו אנזימי האקסונוקלאזות).
להרחבה – Alberts, מהדורה שביעית, ע”מ 261-262 (DNA helicase), עמוד 259 (5′ to 3′ exonuclease) ועמוד 337 (Gyrase).
מולקולרית 5 שאלה 4
מי מההיגדים הבאים אינו נכון אודות ההבדלים ברמת מורכבות מנגנוני בקרת השעתוק באאוקריוטים ופרוקריוטים?
התשובה הנכונה היא ג’- רצפי shine Dalgarno קובעים את אתר תחילת התרגום בפרוקריוטים. הרצף הזה נמצא תמיד ב- mRNA פרוקריוטי, כמה נוקלאוטידים לפני קודון ה- AUG הראשון ואינו קיים ב- mRNA אאקריוטי. באאקריוטים אתר תחילת התרגום נקבע לפי מרחק מה- 5’cap שכן, פקטורי איניציאציית תרגום באאקריוטים סורקים את ה- mRNA מתחילתו ב- 5’cap עד לקודון ה- AUG הראשון בד”כ. מכאן שהמסיח שגוי משתי סיבות, אין רצף shine Dalgarno אאוקריוטי ואילו היה, הרצף קשור לשפעול תרגום ה-mRNA ולא לשעתוקו.
שלילית מסיחים:
א. DNA אאקריוטי ארוך משמעותית מהכמות שניתן לדחוס לגרעין התא האאקריוטי ועל כן הוא דחוס למבנה הכרמוטין. בעת שעתוק או שכפול הכרומטין נפרם מעט על ידי אינזימים מסוג chromatin remodeling. אזורים שאינם משועתקים ימצאו במבנה דחוס במיוחד שנקרא הטרוכרומטין. ואזורים שמשועתקים לעיתים ימצאו במבנה פחות דחוס שנקרא אאוכרומטין.
ב. באאקריוטים יש מנגנון שעתוק מורכב יותר וחלבונים רבים לוקחים בו חלק. מעבר לפקטורי שעתוק כלליים (general transcription factors) שחיונים לכל שעתוק בתא אאקריוטי, יש גם תלות של RNA polymerase 2 בחלבוני mediator (שמקשרים בין האקטיבטור שקשור לאתר האנהנסר לבין RNA פולימראז 2), chromatin remodeling factors ובאקטיבטורים.
ד. המסיח הזה בעצם מסביר את הצורך בחלבוני ה- mediator לדוגמא. שכן, אקטיבטורים רבים נקשרים לאתרי אנהנסר מרוחקים יחסית מהפרומוטור. את הקישור בין האקטיבטור הפעיל ל- RNA polymerase 2 שנמצא על הפרומוטור, עושה ה- mediator. הדבר בד”כ גורם לקיפול מולקולת ה- DNA כך שהאקטיבטור שנמצא קשור לאנהנסר הרחק מהפרומוטור יהיה סמוך ל- RNA פולימראז שקשור לפרומוטור.
להרחבה – Alberts, מהדורה שביעית, עמודים 189-191 (דחיסת כרומוזומים), 334-334 (polymerase II),עמ’ 373-374 (shine delgarno), עמ’ 414-416 (mediator),
מולקולרית 1 שאלה 18
מה יקרה אם תהיה טרה- מתילציה על ליזין בעמדה 27 בהיסטון H3?
התשובה הנכונה- ד׳. מודיפיקציות על היסטונים אכן משנות את מבנה הכרומטין. ישנן כל מיני מודיפיקציות, חלקן פותחות את הכרומטין, חלקן דוחסות אותו. במקרה של טרי מתילציה על ליזין בעמדה 27 על היסטון H3, יגוייס קומפלקס – Reader-writer אל ההיסטונים, קומפלקס PRC2, והכרומטין יסגר וייווצר הטרוכרומטין.
שלילת מסיחים:
א. לא נכון, אנחנו לא יכולים להגיד בהכרח שלא יקרה שום דבר מפני שאנחנו יודעים שיש מתילציות שכן משנות את מבנה הכרומטין.
ב. לא נכון- זה יקרה כאשר תהיה טרי מתילציה על ליזין בעמדה 9 של היסטון H3.
ג. לא נכון. HP1- יגרום לסגירת הכרומטין והיווצרות הטרוכרומטין.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 210-212
מולקולרית 4 שאלה 6
התגלתה מוטציה אשר הופכת קודון של חומצת אמינו לקודון סיום. מה מהבאים נכון לגבי מוטציה זו?
תשובה א‘. מוטציית פסק (Nonsense) היא סוג של מוטציה נקודתית (Point mutation) אשר בה נוקלאוטיד אחד משתנה לאחר, וגורםעקב כך לשינוי הקודון (Codon) שמקודד לח. אמינו מסוימת להיות קודון סיום(Stop codon). במקרה כזה היווצר במהלך התרגום (Translation) פוליפפטיד יותר קצר. במצב הנורמלי שבתא,ישנו מנגנון שנקרא Nonsense-mediateddecay (בקיצור NMD) אשר אחראית לאיתור וגילוי גדילי mRNA אלו והשמדתם. תהליך זה מתרחש בזכותקומפלקסים מיוחדים שנקראים Exonjunction complexes (בקיצור EJC) אשר נמצאים על ה-mRNA באתר החיתוך (Splice site) של כל אינטרון (מתחברים לכל אתר לאחר השחבור). כאשר הריבוזום הראשון מתרגם את ה-mRNA הוא “מפיל” את כל ה-EJC שנמצאים על הגדיל (מכיוון שרץ לכל אורכו עד לאקסון האחרון שמכיל את קודון הסיום). כאשר קודון הסיום ימצא באמצע ה-mRNA, עקב מוטציית Nonsense שיצרה אותו, הריבוזום הראשון שיתרגם את הגן ייעצר באמצע (בקודון הסיום הלא מקורי) ולכן הוא לא יפיל את כל ה-EJC (ב-mRNA תקין לא אמורים להיות כלל EJC עליו). מכיוון שה-EJC נשארו על ה-mRNA יגיעו חלבונים מיוחדים שנקראים Upf אשר יצרו קומפלקס גדול שישלח את ה-mRNA לדגרדציה (Degradation). מנגנון ה-NMD חשוב הן לניצול אנרגטי יעיל למניעת בזבוזאנרגטי והן למניעת יצירת חלבונים מוטנטים שיכולים לגרום נזק לתא.
שלילת מסיחים:
ב’. המושג פולימורפיזם (Polymorphism) מתאר שינוי שחל בגנום שהוא לא נדיר, כלומר שינוי בגנום שהוא נפוץ יחסית. כאשר מדובר על שינוי שבו מוחלף נוקלאוטיד אחד זה יקרא SNP (שזה Single-nucleotide polymorphisms) וכאשר השינוי מתרחש עקב הכנסה או מחיקה (Insertion or Deletion) של מספר נוקלאוטידים זה יקרא אינדל (Indel), במקרה של שינוי קטן, ו-CNV (שזה Copy number variations) במקרה של שינוי נרחב. השינויים הללו אינם גורמים ליצירת חלבון קצר יותר מהרגיל, אלו הבדלים בין גנומים שונים אצל אוכלוסיות שונות, לרוב שונות זאת היא שקטה ואינה באה לידי ביטוי בפנוטיפ כלשהו.
ג’. מוטציית סלף (Missense) היא מוטציה שבה יש שינוי בנוקלאוטיד אחד המשנה את הקודון לקבלת חומצה אמינית שונה. מוטציה זו יכולה להיות שמרנית (Conservative) – שינוי לחומצה אמינית בעלת אותן התכונות (א-פולרית\פולרית\טעונה או ארומטית), או לא-שמרנית (Non-conservative) – שינוי לחומצה אמינית בעלת תכונות שונותמאלו של המקורית. דוגמה נפוצה ניתן למצוא במחלת האנמיה החרמשית (Sic – שינוי מגלוטמט (טעונה שלילית) לואלין (אפולרית)-מוטציה המביאה לאנמיה חרמשית. בשני המצבים נקבל פפטיד השונה בחומצה אמינית אחת.
ד’. מוטציה שקטה (Silence mutation) היאמוטציה שבה יש שינוי בנוקלאוטיד אשר לא מביא לשינוי בחומצה אמינית. למעט מתיונין (Methionine) וטריפטופן (Tryptophan), לכל שאר החומצות האמינו יש בין 2-6 קודונים, מה שמקנה את האפשרות ששינוי בנוקלאוטיד אחד (בדרך כלל השלישי בקודון) לאיביא לשינוי בחומצה האמינית, ועל כן יתקבל חלבון זהה לזה שהיה לפני המוטציה. גם מוטציה זו אינה הופכת לקודון סיום ולכן מסיח זה אינו נכון.
להרחבה – Alberts, מהדורה שביעית, ע”מ 374-375 (Stop codons), ע”מ 378-379 (Nonsense-mediated mRNA decay), ע”מ 324, 525-526 (Polymorphisms), ע”מ 253-254 (Silent mutation) ועמוד 358 (Genetic code).
מולקולרית 1 שאלה 19
במחקרך על חיידק Moomin snorkus, גילית שהוא בעל גנום DNA דו גדילי, בו הנוקליאוטיד G מהווה 31% מהגנום. כמה אחוזים מהגנום יהיה T?
תשובה ד‘. ישנם 4 נוקלאוטידים עיקריים ב-DNA : גואנין (Guanine), אדנין (Adenine), ציטוזין (Cytosine) וטימין (Thymine). נולקאוטידים אלו נחלקים ל-2 סוגים לפי הבסיסים החנקניים (Nitrogenbase) שלהם – פורינים (Purines) אשר בנויים מ-2 טבעות חנקניות ופירמידינים (Pyrimidines) שמכילים טבעת חנקנית אחת. הפורינים (אדנין וגואנין) נקשרים לפירמידינים (ציטוזין וטימין) בגדיל המקביל ע”י קשרי מימן (Hydrogen bond). בהקשר לשאלה, כאשר נתון שהנוקלאוטיד G (גואנין) מהווה כ-31% מכלל הגנום, ניתן להסיק כי נראה נוקלאוטידים מסוג ציטוזין (C) בכמות זהה – גם 31%. יחד הם מהווים כ62% מכלל הגנום. מה שמשאירכ-38% לשאר הנוקלאוטידים (A ו-T). ומכיוון ששניהם גם נמצאים בכמות זהה בגנום (נקשרים אחד לשני), ניתן להסיק כי כל אחד מהם יהיו בנפח של 19% מכלל הגנום (38% לחלק ל-2). ולכן תשובה זו היא הנכונה.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 186-187
מולקולרית 1 שאלה 17
מה סדר פעילות אנזימי האנציאציה בשכפול DNA בפרוקריוטים? (משאל לימין)
התשובה הנכונה- ב׳. משמאל לימין: DnaA – נקשר ל OriC על ידי זיהוי רצפים ספציפים בDNA, מערער את יציבות הדאבל הליקס ומייצר בועית שכפול. DnaC – חלבון מטען (Loader) אליו יקשר ההליקאז (DnaB) ויטעין אותו על גבי הDNA. לבסוף DnaG הפרימאז יטען גם הוא ויסנתז את הפריימר.
שלילת מסיחים:
תשובה א’. שימו לב שהתשובה נכתבה בסדר הפוך משנתבקשנו בשאלה. (מימין לשמאל)
להרחבה- Alberts, מהדורה שביעית, עמ׳ 273-274
מולקולרית 5 שאלה 12
באיזה מהמצבים הבאים נראה את האנזים Aconitase כאשר ישנו מחסור בברזל בתא?
התשובה הנכונה היא ב’- אחת הדוגמאות הקלאסיות לרגולציית התרגום היא על האנזים Aconitase בהקשר רמות הברזל בתוך התא. כזכור מביוכימיה, אנזים זה משתתף במעגל קרבס (Citric acid cycle) ויש לו תפקדי נוסף בבקרת רמות הברזל בתא. כאשר רמות הברזל בתא יורדות האנזים מאבדאת אטום הברזל שלו ומתחבר לרצפים מיוחדים באזורים הלא מתורגמים (UTR=Untranslated region) של ה-mRNA של שני חלבונים חשובים. שני חלבונים אלו הם הפריטין (Ferritin) וטרנספרין (Transferrin). הראשון פועל כחלבון אגירה אשר מסוגל לקשור ברזל במצבי עודף בתא לשעת צורך והשני מהווה כרצפטור על ממברנת התא שמסוגל לבצע אנדוציטוזה (Endocytosis) לאטומי ברזל לתוך התא כאשר ישנו חוסר של ברזל בתא. ולכן במצבים של ריכוז ירוד של ברזל בתא האקוניטאז יאבד את אטום הברזל ויקשר לאזור ה-5’UTR של ה-mRNA שלפריטין על מנת לעכב את תרגומו כי התא זקוק לברזל ולא רוצה לאגור אותו. חשוב לזכור כי אנזים זה יהיה מחובר ל-mRNA רק כאשר יהיה מחסור בברזל.
שלילת מסיחים:
א. האנזים אקוניטאז מסוגל להתחבר רק ל-5’UTR של פריטין ולא ל-3′ ולכן מסיח זה אינו נכון, כנ”ל למצב ההופכי שלו ב-mRNA של טרנספרין – מסוגל להתחבר רק ל-5′ שלו.
ג. כלל “ברזל” (תרתי-משמע) כשאקוניטאז מתחבר ל-5′ הוא מונע תרגום (מכיוון שהתרגום מתחיל בקצה זה), וכאשר אקוניטאז מתחברל-3′ הוא מפעיל שעתוק. ולכן אין צורך להפעיל שעתוק של פריטין כיוון שהתא לא נמצא בעודף ברזל, הוא צריך את הברזל לשימוש מיידי, ולכן מסיח זה אינו נכון.
ד. כפי שנאמר מעל, קשירת ל-5′ מעכבת תרגום וקשירה ל-3′ מפעילה תרגום. וכמו כן במצב של חוסר ברזל התא שואף לעודד ייצור שלטרנספרין (שיכניס ברזל לתא) ולא לעכב אותו.
להרחבה – Alberts, מהדורה שביעית, עמ’ 459-460 (Aconitase)
מולקולרית 2 שאלה 11
איזה מהאנזימים הבאים, מתאפיין בשייר טירוזין באתר הפעיל?
במה השאלה עוסקת: רקומבינציה הומולוגית.
תשובה ב’. ספו11 (Spo11) משמש ליצירת השבר ההתחלתי בתהליך הרקומבינציה ההומולוגית באאוקריוטיים. Spo11 נקשר ומבצע את החיתוך הדו-גדילי. טירוזין באתר הפעיל של האנזים נקשרת לאיזור השבר הדו גדילי בדנ”א. למעשה, שתי מולקולות Spo11 משתתפות וכל אחת מהן תוקפת את אחד הגדילים ונקשרת, באמצעות הטירוזין האתר הפעיל שלה, לקצה ה5′ החדש שנוצר בעקבות הביקוע בכל גדיל. הקישור נעשה בצורה קוולנטית. בספר מצויין כי SPO11 דומה במבנה ובתפקוד שלו לטופואיזומראז 2.
שלילת מסיחים:
א. MRE11 הוא נוקלאז מיוחד ברקומבינציה מיוטית אשר מפרק במהירות את הקצוות אליהם קשור Spo11. הוא מסיר את SPO11 יחד עם הדנ”א שהוא מפרק להשארת קצה 3′ חד גדילי בולט
ג’. החלבון Ku הוא בעל תפקיד מרכזי במנגנון התיקון NHEJ, הטרודימר שתופס את קצה הכרומוזום השבור. חלבונים נוספים דרושים על מנת להחזיק את הקצוות השבורים ביחד, בזמן שהם עוברים עיבוד ובסופו של דבר מחוברים קוולנטית זה לזה
ד. RecA פעיל ברקומבינציה הומולוגית על מנת לזרז את השחלוף בין הגדילים. תחילה נקשר בצורה קואופרטיבית לחד-הגדיל הפולש, ליצירת פילמנט חלבון-דנ”א שמאלץ את הדנ”א להתעוות לצורה מיוחדת – קבוצות של 3 נוקלאוטידים עוקבים מוחזקות בצורה קונבנציונלית אך בין שלישיות שכנות, שלד הדנ”א מסתובב ונמתח. הפילמנט חלבון-דנ”א הבלתי-שגרתי הזה קושר את דופלקס הדנ”א השני בצורה שמותחת את הדופלקס, מערערת את יציבותו ובכך מקלה על ההפרדה בין הגדילים שלו. החד-גדיל הפולש יכול עכשיו לדגום את רצף הדופלקס באמצעות זיווגי בסיסים קונבנציונליים. הדגימה מתרחשת בבלוקים של 3: אם נמצאה התאמה של שלישיית נוקלאוטידים, השלישיה הסמוכה תידגם גם היא, וכן הלאה. בצורה זו, אי-התאמות מובילות להתנתקות מהירה, ורק שטח נרחב של זיווגי בסיסים (לפחות 15 נוקלאוטידים) מייצב את הגדיל הפולש ומוביל לשחלוף בין הגדילים.
להרחבה- Alberts, מהדורה 7, עמ׳ 302-303, 298-299, 294
מולקולרית 4 שאלה 26
רצף האנטיקודון 5-UCG-3 יגיב עם איזה קודון?
- 5-CGA-3
- 5-CGG-3
- 5-GGC-3
- 5-AGC-3
תשובה ד‘. כדי לענות על שאלה זו, חשוב מאד להיות מסודרים מבחינת הכיוונים של הקודון והאנטיקודון.רצף האנטי קודון בשאלה – UCG יבצע צימוד בסיסים רגיל עם שני הנוקלאוטידים הראשונים שבקודון – CG. בשלב זה ניתן כבר לפסול מסיחים שלא מכילים את שני הנוקלאוטידים הראשונים האלה. עכשיו הגענו לעמדת ה-Wobble העמדה הראשונה באנטי-קודון והשלישית בקודון. U (יורודין) יכול לבצע צימוד בסיסים רגיל עם הנוקלאוטיד הקונבנציונלי שלו – A, ובנוסף יכול לבצע צימוד בסיסים עם הנוקלאוטיד G בפרוקריוטים בלבד. ולכן, קיימות שתי אופציות: CGA ו-CGG.

להרחבה – Alberts, מהדורה שביעית, ע”מ 358-361.
מולקולרית 1 שאלה 16
איזו מן היכולות הבאות חסרה באנזים DNA פולימראז אשר אינו מסוגל לבצע הגהה (Proofreading)?
תשובה ב. יכולת ההגהה (Proofreading) ב-DNA polymerase היא היכולת שלו לתקן זיווגי בסיסים שגויים שסונתזו על ידו. כאשרהאנזים מחבר נוקלאוטיד חדש בקצה 3′ החשוף אשר אינו תואם לנוקלאוטיד שנמצא מולו בגדיל התבנית (Template strand) הוא מעביר את הגדיל מאתר הפילמור (Polymerization site) לאתר קטליטי (Editing site) אשר בו מתבצעת פעילות ה-Proofreading, אתר זה דורש קופקטור של מגנזיום (Mg2+) לפעילותו. פעילות זו היא פעילות אקסונוקלאזית (Exonuclease), כלומר ה-DNA polymerase מצבע חיתוך בקצה הגדיל (לכן Exo) ומוציא את הנולקאוטיד השגוי. יכולת זונקראת גם Exonucleolytic proofreading,והיא נעשית בכיוון של 3′ ל-5′ , ולכן תשובה זו היא הנכונה.
שלילת מסיחים:
א’. על מנת לבצע פעילות של הגהה (Proofreading) האנזים נדרש להוריד את הנוקלאוטיד השגוי. פעילות פוספטאזית (Phosphatase) היא יכולת של אנזימים להוריד אטום פוספט בעזרת חיתוך הידרוליטי (Hydrolytic cleavage). הורדת הפוספט מהנוקלאוטיד השגוי לא תתרום לתיקון השגיאה בזיווגי הבסיסים שה-DNA polymerase עשה, ולכן תשובה זו לא נכונה. כזכור, פעילות פוספטאזית ניתן למצוא באנזימים כגון alkaline phosphatase (שמשמש בשיטת ה-Indirect immunocytochemistry), Calcineurin (ביותא – מפעיל את הפקטור NFAT) וכדומה.
ג’. פעילות אקסונוקלאז מכיוון של 5’ל-3′ אינה מאפשרת תיקון בסיסים כיכולת תיקון עצמית של ה-DNA polymerase, מ כיוון שהאנזים מסנתז בכיוון זה (מוסיף נוקלאוטידים חדשים בקצה 5′) ולכן אינו יכול לחתוך את מה שמולו (כי אין מולונוקלאוטידים).
ד’. יכולת אנדונוקלאזית (Endonuclease) היא יכולתו של האנזים לחתוך חומצות גרעין (Nucleic acid) בקשר שמחבר ביניהם – קשר פוספודיאסטרי (Phosphodiester bond). גם יכולת זו אינה רלוונטית ל-DNA polymerase מכיוון שהוא נדרש לבצע הגהה בזמן אמת כאשר ברגע נתון הוא סנתז את הנוקלאוטיד השגוי ובאותו הרגע הוא נדרש לפרקו. האנזים אינו יכול לחזור אחורה לאמצע הגדיל ולחתוך שם.
להרחבה– Alberts, מהדורה שביעית, ע”מ 258-260 (Proofreading), 572-573 (Indirect immunocytochemistry).
מולקולרית 2 שאלה 8
היכן מתרחש תהליך הרפליקציה של וירוס הקורונה?
במה עוסקת השאלה- וירוס הקורונה.
התשובה הנכונה- א׳
הסבר: לוירוס הקורונה אין שלב במחזור החיים שלו בו הוא בתצורה של DNA. הוא אינו נכנס לגרעין התא המאחסן (שלילת מסיח ב). לכן תהליך הרפליקציה שלו קורה ב״אורגנלות״ דו שכבתיות שהוירוס מייצר לעצמו ממברנת ה-ER, של התא אותו הוא תוקף.
שלילת מסיחים-
ג+ד- לא נכונים. יש וירוסים אחרים שיכולים להשתמש במנגנונים הללו כדי לחדור לתאים, אך אין אלה מנגנונים בשימוש ע״י וירוס הקורונה.
להרחבה- Alberts, מהדורה 7, עמ׳ 311-313
מולקולרית 2 שאלה 3
שינויים אבולוציונים כתוצאה מתהליכי ברירה טבעית מביאים להתפתחות מינים בעלי:
במה השאלה עוסקת: Genome evolution.
תשובה ג׳. הברירה הטבעית (Natural selection) גורמת לשינויים אבולוציוניים משמעותיים בעולם, תהליך זה גורם ל”קיצוץ” של אורגניזמים בעלי תכונות פחות מועילות ויעילות להישרדותם בטבע. העדפת תכונות כאלו ואחרות על פני אחרות יוצרות שינויים בדפוס התפתחות המינים וגורמים להעלאת סיכויי ההישרדות של אורגניזמים מסוימים בסביבה הטבעית שלהם. השינויים בתכונות הללו תלויים ישירות בקצב המוטציות (Mutation rate) אשר גורם לשינויים ולרב-גוניות בארסנל התכונות של כל מין. ה-Mutation Rate הוא הקצב שבו מתרחשים השינויים (המוטציות) ברצפי הדנ”א. ניתן לבחון את משתנה זה במעבדה, וחוקרים מצאו כי הוא הכרחי להתפתחות האבולוציה ובלעדיו האורגניזמים לא יוכלו להסתגל לשינויים בסביבה הטבעית שלהם. המוטציות הללו מאפשרות את תהליך הברירה הטבעית, מכיוון שמוטציה שתגרום לתכונה לא-מועדפת (כגון תכונת “ריצה איטית”) לא תאפשר לאורגניזם להאריך חיים, להביא צאצאים ולשרוד, ולכן רק תכונות שיועילו לו יעברו האלה לצאצאים – הברירה הטבעית. שינויים אלו מעלים את הסיכויים להתרבות (הבאת צאצאים) ולכן מסיח זה הוא הנכון.
שלילת מסיחים:
- רמת המורכבות (Complexity) של האורגניזם היא רמת הפשטות או הקושי להבין את התהליכים המניעים אותו. אך לא ניתן לומר כי רמת המורכבות עולה ככל שיש יותר ברירה טבעית מכיוון שתהליך זה דווקא משמר תכונות מועילות, כלומר מעדיף גנים מועילים ולכן אותם גנים ימשיכו לעבור לצאצאים ולא להשתנות.
- השינויים האבולוציוניים שנגרמים עקב הברירה הטבעית גם אינם מורידים את רמת המורכבות של האורגניזמים, ואף לעיתים נראה את ההיפך. כלומר פרטים שעברו מספר של שינויים אבולוציוניים יראו מורכבות יותר גבוהה כגון האדם בהשוואה לחיידקים, כאשר לראשון יש כ-30,000 גנים לעומת כ-500 גנים בממוצע שקיימים בחיידקים.
ד. ההיפך הוא הנכון, סיכויי התרבות גבוהים נמצאו בקשר ישיר עם עודף של גנים חוזרניים. התהליכים העיקריים שמשפיעים על המורכבות של האורגניזם הם הדופליקציות (Duplication) שמתרחשות ברצפים שונים. דווקא ריבוי גנים לא מקודדים (Non-coding genes) אשר נקשרים לרגולציה מוגברת על ביטויי גנים שונים תורמים למורכבות האורגניזם.
להרחבה- Alberts, The Cell 7th Ed., עמ׳ 284-285
פיתרון מלא/הסבר:
חשוב לזכור
מקור
רפרנס
התפלגות תשובות
יצירת קשר
שירות לקוחות
03-656-1234
דוא"ל
תפריט מהיר
תקנון ומדיניות
- תקנון מוצרים
- תקנון מנויים
- מדיניות פרטיות
- מדיניות ביטולים
- תקנון האתר
לא ניתן להעתיק
