שאלון מערכת: שאלון לדוגמא
שאלה 1
החלטת לערוך ניסוי בו הרצת שלוש חומצות אמינו בג׳ל אלקטרופורזה עם גרדיאנט pH כמתואר מטה.
בהנחה שבחרת בחומצות האמינו אספרגין (Asparagine), חומצה אספרטית (Aspartic acid) וארגינין (Arginine), מה יהיה סדר הופעתם בג׳ל לאחר ההרצה (שים/י לב – חומצות האמינו כצובות כסדר הופעתן מכיוון הקתודה לאנודה; משמע מימין לשמאל)?
(-)Cathode 14 13 12 11 10 9 8 7 6 5 4 3 2 1 (+)Anode
במה השאלה עוסקת: מיקוד איזואלקטרי של חומצות אמינו.
תשובה ג. הרצת חלבונים/חומצות אמינו בג’ל אלקטרופורזה עם גרדיאנט pH היא שיטה להפרדדתם על סמך נקודת ה-pI שלהם. pI הוא ערך ה-pH שבו סך המטענים על המולקולה שווה 0. במצב כזה השדה החשמלי בו נמצאת המולקולה לא ישפיע עליה והיא תעצר בג’ל.
מטען החומצה האמינית משתנה בהתאם ל-pH בו היא נמצאת – אם היא נמצאת ב-pH מאוד חומצי, מטענה כנראה יהיה חיובי ולהפך. בהתאם למטען שלה, הח”א תנוע לכיוון האלקטרודה המתאימה (מטען חיובי לקתודה ומטען שלילי לאנודה), עד שתגיע לנקודה בה pH=pI בו מטענה יתאפס והיא תעצר בג’ל.
ארגון חומצות האמינו בג’ל בעל גרדיאנט pH מהקתודה לאנודה יהיה בסדר של pI יורד.
את חומצות האמינו בגוף מחלקים לחמש קבוצות – אליפטיות, ארומטיות, פולריות, טעונות חיובית וטעונות שלילית. לכל חומצות האמינו יש קצה N בסיסי-חיובי וקצה C חומצי-שלילי המשפיעים על תנועתן בשדה חשמלי, ב-pH פיזיולוגי שני הקצוות טעונים ולכן המטען הכולל של המולקולה הוא 0. חומצות אמינו משלוש הקבוצות הראשונות*, שלא מכילות שיירים טעונים, יהיו בעלות pI בין 5 ל-6. לחומצות האמינו החיוביות והשליליות יש גם שייר צד שיכול להתיינן ולכן גם הוא ישפיע על ערך ה-pI: שייר טעון חיובי – שייר שמחובר אליו פרוטון (H+) יעלה את ה-pI הכללי של המולקולה (כי יש צורך ב-pH גבוה יותר לשחרור הפרוטון), שייר טעון שלילית – שייר שחסר לו פרוטון (H+) יוריד את ה-pI הכללי של המולקולה (כי יש צורך ב-pH נמוך יותר כדי שיתחבר פרוטון). בהתאם למידע זה:
ארגינין – ח”א טעונה חיובית בpH פזיולוגי ולכן בעלת pI>>7.
אספרגין – ח”א פולרית לא טעונה, בpH פזיולוגי היא בעלת מטען ניטרלי ולכן pI באיזור 5-6.
אספרטט – ח”א טעונה שלילית בpH פזיולוגי ולכן בעלת pI<<7.
לכן, ארגינין תעצר בנקודה בה pH>>7, אספרגין תעצר בסביבות pH=6 ואספרטט תעצר ב pH<<7, סדר הופעתן מהקטודה לאנודה יהיה בהתאם – ארגינין, אספרגין, אספרטט.
*יוצאות דופן הן ציסטאין (פולרית) וטירוזין (ארומטית): השייר של ציסטאין מכיל קבוצת סולפידריל (Sulfhydryl, SH) בעלת pKr=8 והשייר של טירוזין מכיל קבוצת הידרוקסיל (Hydroxyl, OH) בעלת pKr=10.
להרחבה: Lehninger, מהדורה 6, עמודים 77-85 (חומצות אמינו), 94-95 (מיקוד איזואלקטרי).
שאלה 2
חלבון X יכול לקשור 3 מולקולות של הליגנד שלו Y. נתונים קבועי הדיסוציאציה (Kd) – עבור קישור מולקולת הליגנד הראשונה Kd = 10-7 M , מולקולת הליגנד השניה Kd = 10-8 M ומולקולת הליגנד השלישית Kd = 10-9 M
בהתבסס על מידע זה, איזה מההיגדים הבאים אודות החלבון X נכון?
במה השאלה עוסקת: קואופרטיביות של חלבונים.
תשובה ב’. קבוע היל (nH) מייצג את מידת הקואופרטיביות בקישור חלבון לליגנדים שלו. כאשר nH>1 מתקיימת קואופרטיביות חיובית, מצב בו קשירת ליגנד מעלה את האפיניות של החלבון לקשירת ליגנד נוסף. כאשר nH<1 מתקיימת קואופרטיביות שלילית, מצב בו קשירת ליגנד מורידה את האפיניות של החלבון לקשירת ליגנד נוסף. אם נסתכל בחלבון הנתון בשאלה נראה שקישור ליגנד גורם לירידה בקבוע הדיסוסיאציה Kd (=קבוע פירוק הקומפלקס חלבון-ליגנד), והרי שה- Kd נמצא ביחס הפוך למידת אפיניות הקישור. זאת אומרת – קשירת ליגנד אחד מעלה את האפיניות בין החלבון לליגנד נוסף (כי Ka=1/Kd) כפי שקורה בקואופרטיביות חיובית.
שלילת מסיחים:
1 – אם החלבון לא היה מראה קישור קואופרטיבי, אז ערך ה- Kd שלו היה זהה עבור קשירת שלושת מולקולת הליגנד.
3 – מיוגלובין הוא מונומר עם אתר קישור אחד לליגנד שלו (חמצן), ועל כן הוא מציג קינטיקה שונה לגמרי מאשר חלבון X שהוא קושר את הליגנד באופן שיתופי (קואופרטיבי).
4 – חלבונים שמפגינים שיתופיות חיובית בקשירה מאופיינים בעקומת קישור סיגמואידית (חלבונים שאינם מקיימים שיתופיות, כמו מיוגלובין למשל, מאופיינים בעקומת קישור היפרבולית).
להרחבה — Lehninger מהדורה שמינית, פרק 5.1 עמ’ 657-660
שאלה 3
כמה חומצות אמינו חדשות יוכלו להתווסף לחלבון בתהליך בניית הודות לאנרגיה שתתקבל כתוצאה מחמצון מלא של מולקולת גלוקוז אחת?
במה השאלה עוסקת: אינטגרציה.
תשובה א. בתהליך האלנוגציה (Elongation) של פוליפפטיד המתרחש בתא ע”י הריבוזום נקשרת חומצה אמינית לפוליפפטיד בקשר פפטידי. יצירת הקשר נעשית ע”י תת יחידת RNA שנמצאת בריבוזום הגדול ונקראת פפטידיל טרנספרא .(peptidyl transferase) במהלך יצירת הקשר אין צורך בהכנסת אנרגיה למערכת. איפה כן נדרשת אנרגיה בתהליך האלונגציה? בשלושה מקומות:
(1) חיבור ח”א ל-tRNA מתאים ע”י האנזים Aminoacyl-tRNA Synthetase. אנזים זה צריך לזהות את האנטי-קודון ב-tRNA, להתאים לו ח”א נכונה ולחבר אותה לקצה 3’ב-tRNA. כדי לעשות זאת, האנזים מאקטב את הח”א ע”י חיבורה ל-ATP–>AMP+PPi) AMP) ורק אחר כך מחבר אותה ל- tRNA. שלב זה שווה ערך לשתי מולקולת ATP כי מפורקים שני קשרים עתירי אנרגיה.
(2) כל סבב בתהליך האלונגציה מתחיל כשאתר P בריבוזום מכיל את הפפטיד הבנוי, אתר A פנוי לקבלת tRNA חדש ואתר E ריק. מולקולת ה-tRNA המתאימה מגיעה לאתר A כשהיא קשורה לחלבון נוסף Elongation Factor Tu) EF-Tu) ול-GTP. בסוף הסבב, לאחר יצירת הקשר, אותה מולקולת tRNA נמצאת באתר E של הריבוזום ואין עליה יותר חומצה אמינית. בשלב הזה ה-GTP עובר הידרוליזה GTP–>GDP+Pi וה-tRNA יכול להשתחרר.
(3) תהליך הטרנסלוקציה (Translocation) של הריבוזום. ביצירת הקשר הפפטידי, הפפטיד הישן שנמצא באתר P מתחבר לח”א שנמצאת באתר A כך שהפפטיד החדש נמצא כולו באתר A ו-tRNA ריק נמצא באתר P. כדי שיהיה אפשר להתחיל סבב נוסף אתר A צריך להתרוקן והפפטיד צריך לעבור לאתר P, מעבר זה מתבצע ע”י EF-G תוך כדי הידרוליזה GTP–>GDP+Pi
חמצון מלא של מולקולת גלוקוז כולל גליקוליזה, מעגל קרבס וזירחון חמצוני, כל אחד מתהליכים אלו מספק אנרגיה לתא כך שבסוף התהליך מרוויחים נטו 32ATP.
לכן אם כל הוספה של ח”א דורשת 4 מטבעות אנרגיה וחמצון גלוקוז מספק 32 מטבעות אנרגיה, ניתן להוסיף 8 ח”א חדשות לחלבון בבנייה (32/4=8).
להרחבה: Lehninger, מהדורה 6, עמוד 649 (סיכום אנרגיה מחמצון גלוקוז); Watson, מהדורה 7, עמודים 515-517 (Weaver ;(Aminoacyl-tRNA Synthetase, מהדורה 5, עמודים 569-570 (אלונגציה של חלבונים).
שאלה 4
איזה שני סוגים של צמתים בין-תאיים מכילים אותם מרכיבים חוץ-תאיים אך מתחברים למרכיבים שונים של שלד התא?
במה השאלה עוסקת: צמתים תאיים
תשובה ב’. דזמוזום (Desmosome) וצמתי אדהזיה (Adherens Junction) הם סוג של צמתי תא-תא, כלומר קומפלקסים חלבונים אשר אחראים לעיגון והדבקה של תא לתא שכן. בקצרה – בשני סוגי הצמתים הרכיב החוץ תאי שאליו נקשר הקדהרין זה קדהרין מאותו סוג על גבי התא השכן (בצמתי אדהזיה מדובר בקדהרין קלאסי ובדזמוזום מדובר בקדהרין לא קלאסי), ואילו הרכיב התוך תאי של שלד התא הוא שונה – סיבי אקטין בצמתי אדהזיה וסיבי ביניים בדזמוזומים.
שלילת מסיחים:
א. המי-דזמוזום (Hemidesmosome) ודזמוזום (Desmosome) – המסיח נפסל כי שני סוגי הצמתים הללו מתחברים לאותו מרכיב תוך-תאי של הציטוסקלטון (סיבי ביניים), ולמרכיבים חוץ-תאיים שונים. המידזמוזום זה צומת תא-מטריקס והחיבור הוא ללמינין (גליקופרוטאין מרכזי בלמינה הבאזלית).
ג. צמתי אטימה (Tight Junction) וצמתי הדבקה (Adherens Junction) – מטרתם של צמתי האטימה הוא למנוע מעבר חומרים בין תא לתא. בנוסף הם מגדירים את הכיווניות (הפולאריות) של התא. צמתי אטימה יכולים להיקשר לשלד האקטין בחלקם התוך-תאי. בנוסף החלק הטרנסממברנלי המרכיב את החלק התוך/חוץ תאי מורכב מקלאודין (Claudin) ואוקלודין (Occludin), בעוד שצמתי ההדבקה מכילים קדהרין ונקשרים לסיבי אקטין.
ד. דזמוזום (Desmosome) וצמתי אטימה (Tight Junction) – נקשרים למריכיבים שונים מצידם התוך תאי והמצידם החוץ תאי.
להרחבה- Alberts 7th edition, עמודים 1106-1107 (השוואה בין סוגי צמתים), 1114-1115 (צמתי הדבקה), 1118-1119 (צמתי אטימה) .
שאלה 5
חלבון דמיוני התגלה כבעל תפקיד בפירוק של הליפיד המיטוכונדריאלי קרדיוליפין (Cardiolipin) בתוך הליזוזום. חלבון זה יכיל את הרצפים הבאים:
במה השאלה עוסקת: טרנספורט חלבונים אל הליזוזום.
תשובה א’. על מנת להגיע אל הליזוזום, חלבון ליזוזומלי צריך לעבור את המסלולER>גולג’י>ליזוזום. ב-ER החלבון מתורגם לתוך הטרנסלוקטור הממברנלי Sec61, בגולג’י הוא עובר תהליכי עיבוד שונים ומשם הוא מוסע אל הליזוזום. חלבון שעובר אל ה-ER מכיל רצף הידרופובי שנמצא בקצה ה-N טרמינלי של החלבון ונקרא ER signal sequence . את הרצף הזה מזהה SRP שנקשר אליו ומוביל את החלבון אל תעלת טרנסלוקון Sec61 שנמצאת בממברנת ה-ER. החלבון עובר דרך הטרנסלוקון תוך כדי תרגומו ומשתחרר לתוך הלומן של ה-ER.החלבון עובר גליקוזילציה על שיירי אספרגין. האספרגין חייב להיות חלק מרצף- Asn-X-Thr / Asn-X-Ser. האנזים נקרא Glucosyltransferase והוא מוסיף עץ סוכרי (Glc)3 –(Man)9–(GlcNAc)2 . כאשר החלבון מגיע אל הגולג’י, העץ הסוכרי עובר עיבוד והוא מסומן ב- M6P. במדור ה- TGN של הגולג’י, הרצפטור ל- M6P מזהה את החלבון המסומן ואורז אותו בוזיקולה שתתאחה עם האנדוזום (שיתבגר בסופו של דבר לליזוזום).
כדי ליצור את סימון ה- M6P שיזוהה ברשת הטרנס-גולג׳י, ההידרולאזות הליזוזומליות צריכות להיות מזוהות בגולג׳י ע״י אנזימי הגולג’י שאחראים להוספת M6P. מכיוון שכל הגליקופרוטאינים יוצאים מה- ER עם שרשראות זהות של אוליגוסכריד N-linked, הסיגנל להוספת יחידת M6P לאוליגוסכריד — חייב להימצא איפשהו בשרשרת הפוליפפטידית של כל הידרולאז. סיגנל הזיהוי הזה הוא מקבץ של חומצות אמינו שכנות שיוצרות מבנה ייחודי בפני השטח של ההידרולאז, מה שנקרא סיגנל פאץ׳ (Signal patch).
שלילת מסיחים:
ב. החלבון הינו חלבון מסיס ולכן לא יכול להיות רצף הידרופובי במרכז הגן, אחרת רצף זה ישמש כמקטע טראנסממברנלי של החלבון והוא יהיה חלבון ממברנלי.
ג. רצף KKXX- זהו רצף השבה ל- ER עבור חלבונים ממברנליים. מדובר ברצף שנמצא בקצה ה-C טרמינלי של חלבונים ממברנליים שנועדו לשכון ב-ER. חלבוני המעטפת של COP1 נקשרים ישירות לרצף הזה בחלבון הממברנלי ודואגים להחזיר את החלבון ל-ER במידה והוא בטעות הועבר אל הגולג’י. הרצף הוא 2 חומצות אמינו ליזין (KK) ועוד שתי חומצות אמינו שיכולות להיות מכל סוג (XX).
ד. רצף KDEL- זהו רצף השבה ל- ER שנמצא בקצה ה-C טרמינלי של חלבונים מסיסים תושבי ה- ER. הרצף הוא Lys-Asp-Glu-Leu.
כדאי לזכור שוזיקולה שמנצה מה-ER לגולג’י עטופה ב-COP2 וזו תנועה anterograde ולעומת זאת מהגולג’י ל-ER ב-COP1 וזו תנועה retrograde.
להרחבה- Alberts 7th edition עמודים 768 (טרנספורט של חלבונים אל ה-ER), עמודים 709-711 (stop transfer signal), עמודים 715-716 (N linked glycosylation), עמודים 778-779 (מנוז 6 פוספט)
שאלה 6
מי מבין ההיגדים הבאים הודות טרנספורט של גלוקוז ויוני נתרן הוא נכון?
במה השאלה עוסקת: גרדיאנט אלקטרוכימי.
תשובה ב’. טרנספורט של מולקולות ממדור אחד לאחר מושפע מפרמטרים שונים, כדוגמת הגרדיאנט הכימי ופוטנציאל הממברנה. עבור מולקולות טעונות, הגרדיאנט האלקטרוכימי משקף את האנרגיה החופשית הזמינה להעברת המולקולה בין המדורים, תוך שקלול הרכיביבים הכימיים והחשמליים. הרכיב הכימי הינו גרדיאנט הריכוזים של המולקולה בין שני המדורים והרכיב החשמלי הינו הפוטנציאל החשמלי של הממברנה המפרידה בין שני המדורים.
היות ומולקולת הגלוקוז חסרת מטען, הכוח המניע הפועל על מולקולת הגלוקוז לנוע ממדור אחד לאחר כולל את הרכיב הכימי בלבד, גרדיאנט הריכוזים, כאשר לרכיב החשמלי (פוטנציאל הממברנה) אין השפעה על תהליך זה. במקרה של יון הנתרן, לעומת זאת, שני הרכיבים צריכים להילקח בחשבון, והכוח המניע הפועל על המולקולה הטעונה מגולם במושג המכונה פוטנציאל אלקטרוכימי. משוואת נרנסט משקפת את השקלול של הרכיב החשמלי והרכיב הכימי עבור יון במצב שיווי משקל. כך למשל, במקרה של יון הנתרן פוטנציאל שיווי המשקל של היון הוא בסביבות +50mV. המשמעות של כך היא שבפוטנציאל המנוחה של הממברנה, שהינו בסביבות -70mV, הן הכוח החשמלי והן הכוח הכימי דוחפים אותו לנוע לתוך התא (שכן ריכוז הנתרן הגבוה בסביבה החוץ תאית והסביבה החשמלית השלילית בתוך התא מייצרים כוח מניע לתנועת נתרן לתא).
להרחבה – Berne & Levy, מהדורה 8, עמודים 11-12.
שאלה 7
נתון נוירון A היוצר סינפסות אקסיטטוריות עם שני תאים, B ו- C (כמתואר בסכמה להלן). תא A גורה חשמלית וירה פוטנציאל פעולה בתגובה. במקביל, נרשים שינוי המתח בתאים B ו- C. בתא C נמדד EPSP גדול יותר מזה שנמדד בתא B. כל ההיגדים הבאים יכולים להוות הסבר לממצא זה, מלבד:
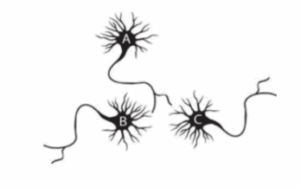
במה השאלה עוסקת: תכונות פאסיביות של נוירונים.
תשובה ג’. ראשית נבין על מה אנו נשאלים בשאלה. מתואר לנו מצב בו נרשם שינוי מתח אקסיטטורי פוסט סינפטי (EPSP) גבוה יותר בנוירון C, בהשוואה לנוירון B, בתגובה לירי של נוירון A (היוצר סינפסה עם שני נוירונים אלה). שלושה מתוך ארבעת הסעיפים יכולים להוות הסבר לממצא זה ועלינו למצוא מהו הסעיף אשר אינו יכול להסביר תוצאות אלה. לכן, נעבור סעיף סעיף ונבין האם האינפורמציה הנתונה יכולה לספק הסבר מתאים לתופעה שהתקבלה בניסוי.
א’. מיקום האלקטרודה ביחס למיקום הסינפסה – כאמור, אנו מדברים בשאלה זועל התכונות הפאסיביות של נוירונים. ידוע לנו כי סיגנל חשמלי שנוצר בתא דועך עם הזמן והמרחק, בהתאם לקבועי הזמן והמרחק של הנוירון, בהתאמה. במידה והאלקטרודה הרושמת, בה נמדד ה-EPSP שנוצר בתגובה לפוטנציאל הפעולה שנוצר בתא A, קרובה יותר בתא C למיקום הסינפסה בהשוואה למיקום האלקטרודה הרושמת בתא B, אכן ייתכן כי יירשם שינוי מתח גדול יותר בתא זה. בתא B שינוי המתח שנוצר מתקדם מרחק גדול יותר עד הגעתו לאלקטרודה הרושמת, ועל כן ידעך יותר עד שייקלט באלקטרודה (גם אם בתחילה היה שווה בגודלו או אף גדול יותר משינוי המתח הראשוני שנוצר בתא באזור הסינפסה).
ב’. השפעת ריכוז הנתרן – כאמור, אנו יודעים כי זרם יוני מושפע הן מהגרדיאנט הכימי של אותו היון והן מפוטנציאל הממברנה. יון הנתרן באופן נורמלי נמצא בריכוז גבוה בסביבה החוץ תאית בהשוואה לריכוזו בתא, וגרדיאנט ריכוזים זה מעודד את מעברו של היון בהתאם למפל הריכוזים. במידה וריכוז יון הנתרן בתא B גבוה בהשוואה לריכוז המקביל בתא C (בהינתן ששניהם נמצאים באותה סביבה חוץ תאית), הכוח המניע הטמון במפל הריכוזים הפועל על יון הנתרן במקרה זה קטן יותר.בהתאם, מצב זה עשוי להסביר מדוע נמדד EPSP קטן יותר בתא B (פחות יוני נתרן ייכנסו ולכן שינוי המתח הדה-פולריזטורי בתא זה יהיה קטן יותר).
ג’. מתח סף – מתח סף נוגע לתכונות האקטיביות של תאי העצב (משמע להיווצרות פוטנציאל הפעולה). שינויי המתח הפוסט-סינפטיים הפאסיביים המדוברים בשאלה, EPSPs (והמקבילים האינהיבטורים – IPSP), אינם מושפעים ממתח הסף. מתח הסף מכתיב רק את מידת האקסיטביליות של הנוירון. ככל שמתח הסף יהיה נמוך יותר כך פוטנציאל הפעולה ייווצר יותר בקלות בתא העצב.
היות ונדרשנו לבחור את הסעיף אשר אינו יכול לספק הסבר לממצאים המוצגים בשאלה, זוהי התשובה הנכונה.
ד’. צפיפות הרצפטורים – הרצפטורים בדנדריטים של תאי העצב (האזור המשמש לקבלת ה-input) קושרים נוירוטרנסמיטרים ובתגובה יכולים להביא לפתיחה של תעלות יונים, באופן ישיר (רצפור יונוטרופי) או עקיף, ובכך לאפשר זרם יונים. צפיפות רצפטורים גבוהה יותר בתא C יכולה להביא לפתיחה שליותר תעלות יונים בתגובה לקשירת מולקולות הנוירוטרנסמיטר המשתחררות מתא A לאחר שנוצר בו פוטנציאל פעולה. כפועל יוצא, זרם היונים בתא C יהיה גדול יותר, דבר אשר יביא לשינוי מתחפוסט-סינפטי משמעותי יותר (למשל, EPSP גדול יותר).
להרחבה – Berne and Levy, Physiology , מהדורה 8, עמודים 89-93.
שאלה 8
למי מחומצות האמינו אין טבעת ארומטית כחלק מהשייר המאפיין אותה?
תשובה: ב’. טבעת ארומטית הינה טבעת פחמנים שישבה קשרים כפולים המייצבים זמנית את כל הפחמנים בטבעת. לפרולין יש מבנה מיוחד- השייר הצידי נסגר על הקצה האמיני ועל הפחמן הקרבונילי לכדי “דמוי טבעת”. אך זוהי איננה טבעת ארומטית. יש להכיר את המבנה של כל חומצות האמינו.
שלילת מסיחים:
א-נכון, לטירוזין יש טבעת ארומטית עם קבוצת הידרוקסיל
ג-נכון, לטריפטופאן יש טבעת ארומטית
ד-נכון, אמנם זה לא נראה שלהיסטידין, אך על פי הספר, גם להיסטידין יש טבעת אימידזול ארומטית.
שאלה 9
על מנת לזהות מיקום של חלבון מסויים בתוך רקמה עבה יש יתרון לשימוש באיזה מיקרוסקופ?
במה השאלה עוסקת: Two photon microscopy
תשובה ב’ . בשיטת Two photon microscopy משתמשים בשני פוטונים בעלי אורכי גל ארוכים יותר שקל להם יותר לחדור את הדגימה, אך תזמון הפגיעה של הפוטונים במטרה קצר מאוד ולכן שווה ערך לפגיעת פוטון יחיד באורך גל קצר יותר. בשיטה זו ניתן לעורר סמנים הנמצאים אפילו בעומק של 250um. מכיוון שבמקרים כאלו המיקרוסקופ רחוק יותר מהדגימה, ניתן להשתמש בו לניתוח הפעילות המוחית בקורטקס של חיה כאשר היא עוד בחיים.
שלילת מסיחים:
א. מיקרוסקופ מסוג SEM סורק את פני השטח של הדגימה ואינו חודר לעומקה.
ג. מיקרוקסופ פלורסנטי מתחלק למיקרוסקופים אפיפלורסנטיים שלרוב משתמשים בנורת כספית כמקור אנרגיה, ולשיטות מתקדמות יותר כמו מיקרוסקופ קונפוקלי שבו משתמשים בלייזר כמקור אנרגיה. מיקרוסקופ קונפוקלי מתאים לדגימות עבות יותר – עד 150 um. כעת ניזכר שב-Two photon microscopy הגבול הינו 250um. כלומר, ניתן לראות שאפילו מיקרוסקופ קונפוקלי אינו מגיע לעומק רקמה שכזה, ועל כן בהכרח המסיח מיקרוסקופ אפיפלורסנטי פחות יעיל לצפייה ברקמות עבות מאשר Two photon microscope.
ד. ב-TIRF ניתן לראות מבנים רק בין 100-200 nm משטח הדגימה (שימו לב שבסעיף ב’ היחידות הינן um).
להרחבה – Alberts, מהדורה 7 עמ’ 580 (two photon microscopy).
שאלה 10
מי מבין ההיגדים הבאים המתייחסים לטלומרים (Telomeres) והאנזים טלומראז (Telomerase) נכון?
הסבר:
תשובה ד. במה עוסקת השאלה: Telomerase.
תשובה ד. הטלומראז (Telomerase) הוא אנזים אאוקריוטי מסוג ריבונוקלאופרוטאין (Ribonucleoprotein) אשר אחראי על הארכת הטלומרים (Telomers) בקצה 3′ בכרומוזומים. בעזרת פעילות זו, הטלומראז נותן מענה לבעיית הקצוות (Endreplication problem) אשר מתרחשת באאוקריוטים עקב אי יכולתו של הפולימראז בסינתזת קצוות הכרומוזום. הטלומראז מכיל גדיל רנ”א מסוג lncRNA אשר ממנו הוא מסנתז רצף חוזרני של GGGTTA בקצה 3′ של הכרומוזום, הארכת הקצה מאפשרת ל-DNA polymerase להמשיך ולהאריך את קצה 5′ של הכרומוזום. יצירת גדיל DNA על בסיס תבנית של RNA נקראת RNA dependent DNA polymerase אשר כזכור קיימת גם באנזימיה-Reverse transcriptase, ולכן תשובה זו היא הנכונה.
שלילת מסיחים:
א׳ ישנם המון סוגים של רצפים חוזרניים (Repeated sequences) לאורך הכרומוזום, למשל רצפי LINE, SINE, Satellite וכדומה. הרצפים החוזרניים של הטלומר (GGGTTA) אינם נמצאים לכל אורכו של הכרומוזום אלא רק בקצוותיו, מכיוון שזהו רצף מיוחד אשר מושך אליו חלבון שנקרא Shelterin שהווה כשכבת הגנה נוספת לקצוות הכרומוזום כנגד נזק אפשרי.
ב׳ רצף הטלומר החוזרני משתנה מאוד בין אורגניזמים שונים, אך ללא ספק הוא אינו עשיר בזיווגי בסיסים שלאדנוזין-טימידין (AT-rich), למשל באורגניזם האאוקריוטי Tetrahymena הטלומר מכיל GGGGTTG או כפי שהודגם מעל, בבני אדם הרצף בטלומר הוא GGGTTA (אשר מכילה 50% רצפי AT-rich). הסבר אפשרי לשכיחות הנמוכה יותר(לרוב) של AT-rich בטלומר טמונה בחוזק קשר גבוה יותר בזיווג הבסיסים של GC אשר מוסיף עוד שכבת הגנה לקצוות הכרומוזום.
ג׳ כפי שנאמר,לטלומראז פעילות של RNA dependent DNA polymerase, כלומר הוא מסנתז דנ”א מתבנית של רנ”א, ולכן תשובה זו אינה נכונה.
להרחבה- Alberts, מהדורה שביעית, ע”מ 281-283 (Telomerase).
שאלה 11
איפה וכיצד מסונתזים מקטעי אוקזאקי (Okazaki fragments)?
במה השאלה עוסקת: Okazaki fragments.
תשובה ג. מקטעי אוקזאקי (Okazaki fragments) מתארים את קטעי ה-DNA שסונתזו במהלך תהליך השכפול (Replication) בגדיל המתעכב (Lagging strand). מקטעים אלו אינם רצפים, זאת לעומת המקטע הארוך שמסונתז בגדיל המוביל (Leading strand) מכיוון שהכיווניות של הגדיל המתעכב הפוכה לכיוון התקדמות מזלג השכפול (לחילופין, מנוגדת לכיוון תנועתו של האנזים Helicase) ולכן היא מתקדמת במקטעים (בכל פעם ההליקאז חופש עוד אזור שמתחיל להיות מסונתז וכן הלאה). מקטעים אלו נמצאים גם בפרוקריוטים (באורך של 1000-2000 נוקלאוטידים) וגם באאוקריוטים (באורכים של 100-200 נוקלאוטידים). כמובן שמקטעי אלו מסונתזים מקצה 5′ לקצה 3′ מכיוון שהפולימראזות (כל סוגי הפולימראזות ללא יוצא מן הכלל!) מסנתזות מכיוון 5′ ל-3′.
הערת המחבר – אחד ההסברים המעניינים להבדל שבין אורכי מקטעי האוקזאקי בפרוקריוטים לאאוקריוטים נעוץ בנוכחותם של הנוקלאוזומים (Nucleosomes) שאחראיים לדחיסת הגנום האאוקריוטי אשר נמצאים במרווחים של 200 נוקלאוטידים לאורך הכרומוזום. כאשר הדנ”א פולימראז דלתאDNA (polymerase δ) שאחראי על סינתזת הגדיל המתעכב מגיע לנוקלאוזום הוא נעצר ולכן אינו מסוגל להמשיך.
שלילת מסיחים:
א . בגדיל המוביל לא יווצר מקטעי אוקזאקי מכיוון שהוא המשכי והדנ”א פולימראז “רץ” עליו ללא הרבה עצירות ולכן אינו מכיל מקטעים קצרים. זה נובע מהסנכרון בכיוון תנועתם של הפולימראז וההליקאז (כלומר הפולימראז עם כיוון פתיחת מזלג השכפול).
ב . בהמשך לנ”ל, מקטעי האוקזאקי (וכן שום סינתזת DNA או RNA) אינה יכולה להתרחש מכיוון 3′ ל-5′ (כלומר שסנתזת נוקלאוטידים חדשים בקצה 5′ בכל פעם), זאת עקב יכולתו של הפולימראז לסנתז רק בכיוון 5′ ל-3′.
ד .כאשר מבינים את כיוון פעולת הפולימראזות, חשוב לא להתבלבל או למהר במסיחים כאלו, ולשים לב לא ליפול במסיחים כאלו שבאים להטעות. אם הכיווניות מבלבלת מעט, אפשר פשוט להשקיע כמה שניות ולצייר זאת על מנת להיות בטוחים.
להרחבה- Alberts, מהדורה שביעית, עמ׳ 260-261
