שאלון מערכת: שיעורי בית ביוכימיה 5
ביוכימיה 5 שאלה 1
מה נכון בנוגע לפעילותו של האנזים ליפופרוטאין ליפאז (lipoprotein lipase)?
במה השאלה עוסקת: ספיגה של חומצות שומן מהמזון.
תשובה א. על מנת שטריגליצרידים (triglycerides) מהמזון ייספגו במעי, יש צורך לפרק אותם. תחילה, מלחי מרה מופרשים מכיס המרה, מתפקדים כדטרגנטים ביולוגיים ויוצרים מיצלות מיקרוסקופיות מחלקיקי השומן המקרוסקופיים שמגיעים מהמזון. מלחי מרה הם אמפיפטיים (amphipathic, חומרים שהם גם הידרופוביים וגם הידרופיליים) והקישור שלהם לשומן ולמים מפרק את חלקיקי השומן הגדולים ומגדיל את שטח הפנים שלהם כך שיותר טריגליצרידים יבואו במגע עם הסביבה המימית. ליפאז (lipase) הוא אנזים מסיס במים המופרש מהלבלב ומפרק טריגליצרידים לדיגליצרידים (diglycerides), מונוגליצרידים (monoglycerides) ואחר כך ל-FFA (free fatty acids) ולגליצרול (glycerol). מלחי המרה שיוצרים שטח פנים גדול יותר לחלקיקי השומן מאפשרים לליפאז לבוא במגע עם יותר טריגליצרידים. תוצרי הפירוק של ליפאז נספגים באפיתל המעי שם הם מומרים חזרה לטריגליצרידים ונקבצים יחד עם כולסטרול וחלבונים, שנקראים ליפופרוטאינים (lipoproteins), ליצירת כילומיקרונים (chylomicrons).
אפוליפופרוטאינים (apolipoproteins) הם חלבונים שמצויים בדם, קושרים שומנים ואחראים להעברתם לרקמות השונות בגוף. התחילית apo מסמנת את מצבם החופשי כאשר הם אינם קשורים לשומנים. ליפופרוטאינים [L1] [nh2] הם אפוליפופרוטאינים במצבם הקשור לשומנים. ישנם מספר סוגים של ליפופרוטאינים שנבדלים בצפיפות הטריגליצרידים בהם, מכילומיקרונים בעלי הצפיפות הגבוה ביותר, דרך VLDL (very-low-densitylipoproteins) ועד VHDL (very-high-density lipoproteins).
כילומיקרונים מאפיתל המעי נספגים למערכת הלימפה ומשם מגיעים לדם. ליפופרוטאין ליפאז (lipoprotein lipase) הוא אנזים שמצוי בנימים של הרקמות בגוף. אפוליפופרוטאין C-II
(apoC-II) מצוי על פני השטח שלהכילומיקרונים וכאשר הם מגיעים לרקמות, apoC-II מפעיל את ליפופרוטאין ליפאז שמפרק טריגליצרידים ל-FFA וגליצרול, ואלה נספגים בתאים.
שלילתמסיחים:
ב. שומן מהמזון נספג במעי בעזרת האנזים ליפאז (ולא אפוליפופרוטאין ליפאז), ראה פירוט לעיל.
ג. פירוק מאגרי טריגליצרידים תוך תאיים נעשה ע”י 3 אנזימים שונים בעקבות הפעלה הורמונלית. גלוקגון או אפינפרין נקשרים לרצפטור ומפעילים קסקדת סיגנלים שבסופה מופעל האנזים PKA (Protein Kinase A). PKA מזרחן hormone sensitive lipase (HSL) ופריליפינים (perilipins) שהינם חלבונים שמצויים על פני השטח של טיפת השומן. זירחון של פריליפינים גורם לניתוק של החלבון CGI שמפעיל את האנזים ATGL (adipose triacylglycerol lipase). אנזים זה מפרק טריגליצרידים לדיגליצרידים. הפריליפינים המזורחנים מאפשרים ל-HSL לעבור אותם ולהיכנס לטיפת השומן שהם הוא מפרק דיגליצרידים למונוגליצרידים. הליפאז השלישי הוא MGL (monoacylglycerollipase) שמפרק מונוגליצרידים ל-FFA ולגליצרול. FFA יוצאות מטיפת השומן, נקשרות לאלבומין בסרום ומוסעות לרקמה הזקוקה להן.
כדאי לזכור בהקשר זה את קסקדת הסיגנלים המופעלת בעקבות קישור גלוקגון או אפינפרין ל- G protein coupled receptor (GPCR) עם תת יחידה אלפא מסוג Gs. הרצפטור משנה קונפורמציה, מתפקד כ-GEF (guanine nucleotide exchangefactor) וגורם לניתוק GDP מתת יחידה אלפא בחלבון G ולקישור GTP. חלבון G משנה קונפורמציה וכך תת יחידה אלפא מתנתקת מתתי יחידות בטא וגמא ומפעילה את האנזים Adenylyl cyclase שיוצר cAMP מ-ATP. 4 מולקולות של cAMP נקשרות לשתי היחידות הרגולטוריות של PKA ומנתקות אותן כך ש-PKA מופעל ומזרחן חלבונים במורד הזרם.
ד. ליפופרוטאין ליפאז הוא אנזים הפועל על מולקולות שומניות בליפופרוטאינים ומפרק אותן לתתי יחידות קטנות יותר. הוא אינו פועל על החלבונים בליפופרוטאינים ולכן לא מפרק אותן לחומצות אמינו.
להרחבה- Lehninger,מהדורה שישית, עמודים 668-669 (ספיגת שומן מהמזון במעי),864-866 (ליפופרוטאינים), 669-670 (פירוק מאגרי שומן). Alberts, מהדורהשישית, עמודים 832-833 (GPCR ויצירת cAMP).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן.
להרחבה- Lehninger,מהדורה שמינית, פרק 17- עמודים 2182-2185 (ספיגת שומן מהמזון במעי),פרק 21- 2745-2747 (ליפופרוטאינים), פרק 17- 2186-2190 (פירוק מאגרי שומן). Alberts, מהדורה שביעית, פרק 15- עמודים 892-894 (GPCR ויצירת cAMP).
ביוכימיה 5 שאלה 2
מה נכון בנוגע לחומצות שומן בזרם הדם:
במה השאלה עוסקת: פירוק מאגרי שומן.
תשובה ב. FFA (free fatty acids, חומצות שומן חופשיות) הן הידרופוביות ולכן לא מוסעות בדם במצבן החופשי אלא נזקקות לחומר אמפיפטי (amphipathic, חומרים שהם גם הידרופוביים וגם הידרופיליים) שיסיע אותן. חלבון הסרום אלבומין (Bovine SerumAlbumin, BSA) שמהווה כ-50% מהחלבונים בסרום, נקשר באופן לא קוולנטי ביחס של 10 FFA למונומר של אלבומין. בצורה כזו FFA יוצאות מטיפת השומן, נקשרות לאלבומין בסרום ומוסעות לרקמה הזקוקה להן.
שלילת מסיחים:
א. המוגלובין שייך למשפחת הגלובינים שבה לכל החלבונים יש מבנה שניוני ושלישוני דומה. גלובינים מצויים באאוקריוטים ובחלק מהחיידקים (פרוקריוטים) ורובם מתפקדים כנשאים של חמצן או עוזרים לאגירה שלו. התפקיד של ההמוגלובין הוא לקשור ולהסיע חמצן בדם ואינו מתפקד כנשא לחומצות שומן בדם.
ג. FFA הן הידרופוביות ולא מוסעות בדם במצבן החופשי.
ד. פירוק מאגרי טריגליצרידים תוך תאיים נעשה ע”י 3 אנזימים שונים בעקבות הפעלה הורמונלית. גלוקגון או אפינפרין נקשרים לרצפטור ומפעילים קסקדת סיגנלים שבסופה מופעל האנזים PKA (Protein Kinase A). PKA מזרחן hormone sensitive lipase (HSL)ופריליפינים (perilipins) שהינם חלבונים שמצויים על פני השטח של טיפת השומן. זירחון של פריליפינים גורם לניתוק של החלבון CGI שמפעיל את האנזים ATGL (adiposetriacylglycerol lipase). אנזים זה מפרק טריגליצרידים לדיגליצרידים. הפריליפינים המזורחנים מאפשרים ל-HSL לעבור אותם ולהיכנס לטיפת השומן שהם הוא מפרק דיגליצרידים למונוגליצרידים. הליפאז השלישי הוא MGL (monoacylglycerol lipase) שמפרק מונוגליצרידים ל-FFA ולגליצרול.
להרחבה- Lehninger,מהדורה שישית, עמודים 669-670 (פירוק מאגרי שומן), 159(משפחת הגלובינים), 163 (המוגלובין ונשיאת חמצן).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן.
להרחבה- Lehninger, מהדורה שמינית, פרק 17- עמודים 2186-2190 (פירוק מאגרי שומן), פרק 5- 622-624 (משפחת הגלובינים), פרק 5- 640-641 (המוגלובין ונשיאת חמצן).
ביוכימיה 5 שאלה 3
תפקידו של האנזים ליפאז רגיש להורמון (hormone-sensitive-lipase) הוא:
במה השאלה עוסקת: פירוק מאגרי שומן.
תשובה ג. פירוק מאגרי טריגליצרידים תוך תאיים נעשה ע”י 3 אנזימים שונים בעקבות הפעלה הורמונלית. גלוקגון או אפינפרין נקשרים לרצפטור ומפעילים קסקדת סיגנלים שבסופה מופעל האנזים (Protein Kinase A). האנזים PKA מזרחן את hormonesensitive lipase (HSL) ופריליפינים (perilipins) שהינם חלבונים המצויים על פני השטח של טיפת השומן. זירחון של פריליפינים גורם לניתוק של החלבון CGI (Comparative Gene Identification) שמפעיל את האנזים ATGL (adiposetriacylglycerol lipase). אנזים זה מפרק טריגליצרידים לדיגליצרידים. הפריליפינים המזורחנים מאפשרים ל-HSL לעבור אותם ולהיכנס לטיפת השומן ולפרק בה דיגליצרידים למונוגליצרידים. הליפאז השלישי הוא MGL (monoacylglycerol lipase) שמפרק מונוגליצרידים ל-FFA ולגליצרול.
שלילת מסיחים:
א. HSL מצוי באדיפוציטים (תאי שומן) ואחראי על פירוק הטריגליצרידים האגורים שם ושחרורם לדם ולא אחראי לפירוק ליפידים בהפטוציטים.
ב. הורמונים סטרואידים נוצרים מכולסטרול בקורטקס האדרנל, השחלות והאשכים, ולא מפוספוליפידים המצויים בממברנה. אקוזינואידים (Eicosanoids) הם מולקולות סיגנל שומניות שמעבירות סיגנל בצורה פראקרינית (פעילות על תאים סמוכים לאלה שיצרו אותן) שכן מיוצרת מפוספוליפידים. כתגובה לסיגנל, האנזים פוספוליפאז A2 שמצוי ברוב התאים של יונקים, מפרק פוספוליפידים לשחרור של חומצה ארכידונית מהפחמן האמצעי בגליצרול. אנזימים ב-SER (smooth endoplasmic reticulum) ממירים את ארכידונת לפרוסטגלנדינים שמתפקדים במגוון תהליכי דלקת,קרישת דם ועוד.
ד. סינתזת ליפידים מתרחשת בעיקר בכבד, ברקמת שומן ובבלוטות חלב בשדיים. האנזימים המשתתפים בתהליך הם האנזים ACC (acetyl CoA carboxylase) והאנזים- FAS (fatty-acyl-sythase).
האנזים HSL לא משתתף בסינתזה או בחימצון בטא של חומצות שומן. אנזים זה אחראי על שחרור חומצות שומן חופשיות מאדיפוציטים לדם.
להרחבה- Lehninger,מהדורה שישית, עמודים 669-670 (פירוק מאגרי שומן), 833-839(סינתזה של חומצות שומן), 845 (יצירת פרוסטגלנדינים), 874 (ייצור הורמונים סטירואידים).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן.
להרחבה- Lehninger,מהדורה שמינית, פרק 17- עמודים 2186-2190 (פירוק מאגרי שומן), פרק 21, 2645-2670 (סינתזה של חומצות שומן), 2687-2688 (יצירת פרוסטגלנדינים), 2767-2770 (ייצור הורמונים סטירואידים).
ביוכימיה 5 שאלה 4
הגילצרול המתקבל מהידרוליזה של טריאצילגליצרולים (triacylglycerols) נכנס לגליקוליזה כ:
במה השאלה עוסקת: פירוק מאגרי שומן.
תשובה ג. טריגליצרידים ממאגרי שומן מתפרקים ל-FFA (free fatty acids) ולגליצרול. הגליצרול מזורחן ע”י גליצרול קינאז (glycerol kinase) ליצירת glycerol 3-phosphate. תוצר זה מחומצן ע”י
glycerol 3-phosphate dehydrogenase ל-dihydroxyacetone phosphate ומשם התוצר נכנס לריאקציה החמישית בגליקוליזה.
שלילתמסיחים:
א. גליצרול היא מולקולה בעלת 3 פחמנים, גלוקוז היא מולקולה בעלת 6 פחמנים. תיאורטית על מנת שגליצרול יכנס לגליקוליזה כגלוקוז יש צורך בהשקעת אנרגיה. גליצרול מפורק בגליקוליזה כאשר לגוף יש צורך באנרגיה ולכן אינו נכנס לגליקוליזה כגלוקוז.
ב. ראה הסבר למסיח א.
ד. פירובט הוא התוצר האחרון בגליקוליזה ובעל האנרגיה החופשית הנמוכה ביותר מבין המשתתפים בתהליך. על מנת לנצל ביעילות כמה שיותר מהאנרגיה האצורה בגליצרול, הוא נכנס בשלב 5 של הגליקוליזה ופירוק שלו לפירובט מייצר NADH ו-2ATP.
להרחבה- Lehninger,מהדורה שישית, עמודים 544-555 (גליקוליזה) *במיוחד עמוד 547 תמונה 14-3, 670-671 (כניסת גליצרול ממאגרי שומן לגליקוליזה).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן.
להרחבה- Lehninger, מהדורה שמינית, פרק 14- עמודים 1870-1904 (גליקוליזה) *במיוחד עמוד 1876 תמונה 14-3, פרק 17- 2187-2192 (כניסת גליצרול ממאגרי שומן לגליקוליזה).
ביוכימיה 5 שאלה 5
מה מהבאים יכול לחדור את הממברנה הפנימית במיטוכונדריה?
במה השאלה עוסקת: חימצון בטא- β oxidation.
תשובה ב. חימצון בטא הוא תהליך בו חומצות שומן מומרות ל-Acetyl CoA, שבהמשך מפורק במעגל קרבס ל-CO2. תהליך זה מאפשר ניצול של חומצות שומן ליצירת אנרגיה זמינה ומהווה חלק מרכזי מתהליכי יצירת האנרגיה ברקמות מסוימות בגוף (מספק 80% מהדרישות האנרגטיות של הלב והכבד). בבעלי חיים, חימצון בטא מתרחש במטריקס של המיטוכונדריה. חומצות שומן עם 12 פחמנים ומטה יכולות לעבור את הממברנה של המיטוכונדריה בדיפוזיה. חומצות שומן עם 14 פחמנים ומעלה, שמהוות את עיקר חומצות השומן המגיעות מהמזון, זקוקות לטרנספורטרים של ה-carnitineshuttle.
בריאקציה הראשונה של השאטל חומצת שומן מצומדת ל-CoA ליצירת fatty acyl-CoA, תוך שימוש בATP. האנזים שמזרז את הריאקציה הוא Acyl-CoA synthetase שממוקם על הממברנה החיצונית של המיטוכונדריה.
Carnitineacyl transferase I הוא אנזים המזרז את הריאקציה השנייה ב- carnitine shuttle. בריאקציה זו מתרחשת טרנס-אסטריפיקציה של קרניטין ל-fatty acyl-CoA (כדוגמת Palmitoyl-CoA) ליצירתfatty acyl-carnitine. התוצר מועבר בדיפוזיה דרך טרנספורטר למטריקס של המיטוכונדריה.
שלילת מסיחים:
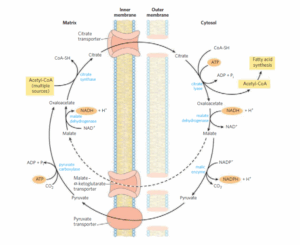
א. Acetyl-CoA לא יכול לעבור את הממברנה של המיטוכונדריה בדיפוזיה פשוטה אלא עובר דרך שאטל עקיף. Acetyl-CoA במטריקס מומר ל-Citrate בתגובה עם Oxaloacetate. תגובה זו מתרחשת במעגל קרבס (הריאקציה הראשונה במעגל) בזירוז האנזים Citrate synthase. Citrate עובר את הממברנה הפנימית של המיטוכונדריה דרך Citrate transporter. בציטוזול Citrate מתפרק חזרה ל-Acetyl-CoA ול-Oxaloacetate בזירוז האנזים Citrate lyase תוך שימוש באנרגיה מהידרוליזה של ATP. על מנת לחזור למטריקס, Oxaloacetate מומר ל-Malate בזכות חיזור ע”י Malatedehydrogenase (תהליך הפוך מהריאקציה האחרונה במעגל קרבס) שמשתמש באלקטרונים מ-NADH. Malate חוזר למטריקס דרך Malate- a-Ketoglutaratetransporter. כדי להשלים את השאטל, Malate עובר חימצון חזרה ל-Oxaloacetate. מסלול אלטרנטיבי ל-Malate הנוצר בציטוזול הוא ליצור NADPH, Pyruvate ו-CO2 בזירוז האנזים Malic enzyme (הריאקציה ההפוכה שאנזים זה מזרז היא אנפלרוטית למעגל קרבס. anaplerotic reactions, תגובות שמספקות מגיבים בתהליכים מטבוליים). ה-Pyruvate שנוצר בתהליך עובר דרך Pyruvate transporter למטריקס של המיטוכונדריה שם הוא מומר ל-Oxaloacetate ע”י Pyruvate carboxylase תוך שימוש באנרגיה מהידרוליזה של ATP. המסלול האלטרנטיבי של Malate יוצר שאטל שדורש 2 מולקולות ATP (בריאקציות של Citrate lyase ו-Pyruvate carboxylase) לכל מעבר של Acetyl-CoA לציטוזול. אך בזכות הפירוק שלMalate ל-Pyruvate ו-CO2 ע”י Malic enzyme נוצרת כמחצית מכמות ה-NADPH הדרושה לסינתזה של חומצות שומן. מסלול ה-pentose phosphate יוצר את המחצית השנייה של NADPH שצריך.
ב. fatty acyl-CoA הוא תוצר הריאקציה הראשונה בקרניטין שאטל (carnitine shuttle). תוצר זה לא יכול לעבור את הממברנה הפנימית של המיטוכונדריה, אלא צריך לעבור את הריאקציה השנייה בשאטל ולהפוך ל-fatty acylcarnitine. תוצר זה יכול לעבור את הממברנה השנייה של המיטוכונדריה בעזרת טרנספורטר. ראה פירוט לעיל.
ד. Malonyl CoA הוא התוצר הראשון בתהליך הסינתזה של חומצות שומן בציטוזול מ-acetylCoA. הוא נוצר בציטוזול ומשמש לסינתזה של חומצות שומן בציטוזול ולכן לא עובר את הממברנה של המיטוכונדריה.
להרחבה- Lehninger, מהדורה שישית, עמודים 651 (תגובות אנפלרוטיות) 671-672 (carnitine shuttle), 833 (Malonyl CoA וסינתזת חומצות שומן),840 (Citrate-acetate shuttle).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן.
להרחבה- Lehninger, מהדורה שמינית, פרק 16- עמודים 2134-2136 (תגובות אנפלרוטיות), פרק 21, 2648- 2650(carnitine shuttle), (Malonyl CoA וסינתזת חומצות שומן),2670 (Citrate-acetate shuttle).
ביוכימיה 5 שאלה 6
מהו סדרם הנכון של האנזימים הפועלים בחמצון בטא (beta oxidation)?
שימי לב לסדר את האנזימים משמאל לימין.
( I ) בטא הידרוקסיאציל קו- A דהידרוגנאז (β-hydroxyacyl-CoA dehydrogenase).
( II ) תיולאז (thiolase).
( III ) אנואיל קו- A הידרטאז (enoyl-CoA hydratase).
( IV ) אציל קו- A דהידרוגנאז (acyl-CoA dehydrogenase).
במה השאלה עוסקת: חימצון בטא- β oxidation.
תשובה ג. חימצון בטא הוא תהליך בו חומצות שומן מומרות ל-AcetylCoA, שבהמשך מפורק במעגל קרבס ל-CO2. תהליך זה מאפשר ניצול של חומצות שומן ליצירת אנרגיה זמינה ומהווה חלק מרכזי מתהליכי יצירת האנרגיה ברקמות מסוימות בגוף (מספק 80% מהדרישות האנרגטיות של הלב והכבד). בבעלי חיים, חימצון בטא מתרחש במטריקס של המיטוכונדריה. התהליך המקדים לחימצון בטא מאפשר את המעבר של חומצת השומן מהציטוזול למיטוכונדריה דרך טרנספורטרים ונקרא carnitineshuttle. בריאקציה הראשונה של תהליך זה חומצת השומן מצומדת ל-CoA ליצירת fattyacyl-CoA, תוך שימוש בATP. תוצר זה מועבר דרך השאטל לתוך המטריקס של המיטוכונדריה ומשמש כסובסטרט הראשון בתהליך חימצון בטא. 4 אנזימים משתתפים בתהליך חימצון בטא.
(IV) הריאקציה הראשונה מזורזת ע”י האנזים acyl-CoA dehydrogenase שמחמצן את ה-fattyacyl-CoA ליצירת קשר כפול בין פחמן a ל-b (C-2 ו-C-3) ומתקבל התוצר trans-Δ2-enoyl-CoA (Δ2 מסמן את מיקום הקשר הכפול). האלקטרונים מהקשר בין פחמנים a ו-b מועברים לנשא האלקטרונים FAD ליצירת FADH2. נשא זה קשור ל- acyl-CoA dehydrogenase קוולנטית כקבוצה פרוסטטית ומעביר את האלקטרונים לנשא אלקטרונים של שרשרת הנשימה במיטוכונדריה.
כדאי לדעת בהקשר זה שישנם 3 איזואנזימים (isoenzymes) ל-acyl-CoA dehydrogenase, כל אחד ספציפי לאורך אחר של חומצת שומן. VLCAD (very-long-chainacyl-CoA dehydrogenase) פועל על חומצות שומן באורך של 12-18 פחמנים, MCAD (medium-chain acyl-CoA dehydrogenase) פועל על חומצות שומן באורך של 4-14 פחמנים, SCAD (short-chain acyl-CoA dehydrogenase) פועל על חומצות שומן באורך של 4-8 פחמנים.
(III) בריאקציה השנייה של חימצון בטא, H2O מוסף לקשר הכפול של trans-Δ2-enoyl-CoA וכך הקשר נפתח ונוצר b-hydroxy-acyl-CoA. ריאקציה זו מזורזת ע”י האנזים enoyl-CoAhydratase.
(I) התוצר של ריאקציה זו עובר חימצון נוסף בריאקציה השלישית, שמזורז ע”י האנזים b-hydroxyacyl-CoA dehydrogenase ומתקבל b-ketoacyl-CoA. מקבל האלקטרונים הוא NAD+ שהופך ל-NADH ומוסר את האלקטרונים שלו לנשא האלקטרונים של שרשרת הנשימה NADH dehydrogenase.
(II) הריאקציה הרביעית והאחרונה של חימצון בטא מזורזת ע”י האנזים acyl-CoA acetyltransferase שנקרא גם thiolase. אנזים זה מזרז את ההתקפה הנוקליאופילית של coenzyme A על פחמן b ב-b-ketoacyl-CoA כך שבסופה acetyl-CoA שמכיל את פחמן a מתנתק ולחומצת השומן המקוצרת ב-2 פחמנים מתחבר Co-A לפחמןשהיה פחמן b.
להרחבה- Lehninger,מהדורה שישית, עמודים 673-674 (חימצון בטא).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן.
להרחבה- Lehninger,מהדורה שמינית, פרק 17, עמודים 2197-2204 (חימצון בטא).
ביוכימיה 5 שאלה 7
כמה מולקולות ATP נטו ייווצרו בחמצון מלא של חומצת השומן פלמיטאט (palmitate), בת ה- 16 פחמנים והרוויה, בחמצון ביטא (beta oxidation) ומעגל קרבס?
במה השאלה עוסקת: חימצון בטא- β oxidation.
תשובה א. חימצון בטא הוא תהליך בו חומצות שומן מומרות ל-AcetylCoA, מולקולה בעלת 2 פחמנים שבהמשך מפורקת במעגל קרבס ל-CO2. תהליך זה מאפשר ניצול של חומצות שומן ליצירת אנרגיה זמינה ומהווה חלק מרכזי מתהליכי יצירת האנרגיה ברקמות מסוימות בגוף (מספק 80% מהדרישות האנרגטיות של הלב והכבד). בבעלי חיים, חימצון בטא מתרחש במטריקס של המיטוכונדריה ע”י 4 אנזימים. סבב אחד של התהליך הכולל-חימצון, הידרציה, חימצון ותיוליזה (Thiolysis), מניב מולקולה אחת של acetyl-CoA, fatty acyl-CoA שקצרה ב-2 פחמנים, FADH2,NADH + H+. לחומצת השומן פפלמיטט (palmitate) יש 16 פחמנים ולכן יש צורך ב-7 סבבים של חימצון בטא כדי לפרק אותה ל-8 מולקולות של acetyl-CoA, 7 FADH2, 7 NADH + H+.
כל מולקולה של FADH2 תורמת 2 אלקטרונים לשרשרת הנשימה ומתקבלות 1.5 מולקולות של ATP במעבר של האלקטרונים לחמצן. כל מולקולה של NADH תורמת 2 אלקטרוני לשרשרת הנשימה ומתקבלות 2.5 מולקולות של ATP. מכאן שלכל סבב של חימצון בטא מתקבלות 4 מולקולות (1.5+2.5) של ATP כתוצאה מנשאי האלקטרונים. ב-7 סבבים של חימצון בטא לפלמיטט מתקבלות 8 מולקולות של acetyl-CoA ו-28 מולקולות של ATP.
acetyl-CoA נכנס למעגל קרבס, בכל סבב במעגל נוצרים: 3 NADH, ATP ו-FADH2. מ-8 מולקולות של acetyl-CoA שעוברות במעגל קרבס ומניבות תוצרים העוברים בשרשרת הנשימה נוצרות 80 מולקולות של ATP.
סך הכל, חימצון בטא של חומצת השומן פלמיטט מניב 108 מולקולות ATP: 80 מולקולות ATP מ-8 acetyl-CoA ו- 28 מולקולות ATP מ- 7 FADH2 ו- 7 NADH + H+.
מכיוון ששפעול חומצת השומן דורש 2 מולקולות ATP אז בנטו נרוויח 106 מולקולות ATP.
להרחבה- Lehninger,מהדורה שישית, עמודים 674-675 (חימצון בטא).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן.
להרחבה- Lehninger,מהדורה שמינית, פרק 17, עמודים 2206-2207 (חימצון בטא), 2210-2212.
ביוכימיה 5 שאלה 8
מה מהבאים נכון בנוגע לחמצון מולקולת פלמיטאט (palmitate) (16:0), במסלול חמצון ביטא (beta oxidation) המתחיל בחומצת השומן החופשיה בציטופלסמה?
( I ) אקטיבציה של חומצת השומן החופשיה דורשת שני אקוויולנטים של ATP.
( II ) נוצר פירופוספט אנאורגני (PPi).
( III ) קרניתין (carnitine) מתפקד כקולט אלקטרונים.
( IV ) נוצרים 8 מול (mole) של FADH2 .
( V ) נוצרים 8 מול (mole) של אצטיל קו- A.
( VI ) אין מעורבות ישירה של +NAD.
במה השאלה עוסקת: חימצוןבטא- β oxidation.
תשובה ב. חימצון בטא הוא תהליך בו חומצות שומן מומרות ל-Acetyl CoA, מולקולה בעלת 2 פחמנים שבהמשך מפורקת במעגל קרבס ל-CO2. תהליך זה מאפשר ניצול של חומצות שומן ליצירת אנרגיה זמינה ומהווה חלק מרכזי מתהליכי יצירת האנרגיה ברקמות מסוימות בגוף (מספק 80% מהדרישות האנרגטיות של הלב והכבד). בבעלי חיים, חימצון בטא מתרחש במטריקס של המיטוכונדריה. חומצות שומן עם 12 פחמנים ומטה יכולות לעבור את הממברנה של המיטוכונדריה בדיפוזיה. חומצות שומן עם 14 פחמנים ומעלה, שמהוות את עיקר חומצות השומן המגיעות מהמזון, זקוקות לטרנספורטרים של ה-carnitine shuttle.
(I), (II) בריאקציה הראשונה של השאטל חומצת שומן מצומדת ל-CoA ליצירת fattyacyl-CoA. כך למשל, חומצת השומן Palmitate (בעלת 16 פחמנים), תהפוך בריאקציה זו לPalmitoyl-CoA. האנזים שמזרז את הריאקציה הוא Acyl-CoA synthetase שממוקם על הממברנה החיצונית של המיטוכונדריה. הריאקציה דורשת ATP שנחתך ל-AMP ול-PPi שנחתך גם הוא ל-2Pi. בעצם יש צורך בשני קשרים פוספואנהידרידים (phosphoanhydride- הקשר בין פוספטים במולקולת ATP) בATP כדי לבצע אקטיבציה לחומצת השומן. האקטיבציה מתבטאת בקשר עתיר האנרגיה שקיים בין הגופרית ב- Coenzyme A לקבוצת קרבוקסיל בחומצת השומן. אקטיבציה זו תאפשר את תהליך הניתוק של acetyl-CoA מחומצת השומן בחימצון בטא.
(III) Carnitine acyltransferase I הוא אנזים המזרז את הריאקציה השנייה ב- carnitine shuttle. בריאקציה זו מתרחשת טרנס-אסטריפיקציה של קרניטין ל-fatty acyl-CoA (כדוגמת Palmitoyl-CoA) ליצירתfatty acyl-carnitine. התוצר מועבר בדיפוזיה דרך טרנספורטר למטריקס של המיטוכונדריה. תהליך הכניסה של חומצות שומן למיטוכונדריה דרך shuttle זה, הואשלב קובע מהירות בחימצון של חומצות שומן ומהווה נקודת בקרה חשובה.
(IV), (V), (VI) חימצון בטא הוא תהליך חוזרני שכולל 4 שלבים- חימצון, הידרציה, חימצון ותיוליזה (Thiolysis). החימצון הראשון בתהליך מערב את נשא האלקטרונים FAD. החימצון השני מערב את נשא האלקטרונים NAD+. סבב אחד של חימצון בטא מניב מולקולה אחת של acetyl-CoA,fatty acyl-CoA שקצרה ב-2 פחמנים, FADH2, NADH + H+. לחומצת השומן פפלמיטט (palmitate) יש 16 פחמנים ולכן יש צורך ב-7 סבבים של חימצון בטא כדי לפרק אותה ל-8 מולקולות של acetyl-CoA, 7 FADH2, 7 NADH + H+.
להרחבה- Lehninger,מהדורה שישית, עמודים 670-675 (חימצון בטא).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן.
להרחבה- Lehninger, מהדורה שמינית, פרק 17, עמודים 2205-2187 (חימצון בטא).
ביוכימיה 5 שאלה 9
בחר/י במולקולה אשר חמצון מלא של מול אחד שלה יניב את כמות ה- ATP הגדולה ביותר:
במה השאלה עוסקת: חימצון בטא- β oxidation.
תשובה ב. חימצון בטא הוא תהליך בו חומצות שומן מומרות ל-Acetyl CoA, מולקולה בעלת 2 פחמנים שבהמשך מפורקת במעגל קרבס ל-CO2. תהליך זה מאפשר ניצול של חומצות שומן ליצירת אנרגיה זמינה ומהווה חלק מרכזי מתהליכי יצירת האנרגיה ברקמות מסוימות בגוף (מספק 80% מהדרישות האנרגטיות של הלב והכבד).בבעלי חיים, חימצון בטא מתרחש במטריקס של המיטוכונדריה ע”י 4 אנזימים. סבב אחד של התהליך הכולל- חימצון, הידרציה, חימצון ותיוליזה (Thiolysis), מניב מולקולה אחת של acetyl-CoA,fatty acyl-CoA שקצרה ב-2 פחמנים, FADH2, NADH + H+.
כל מולקולה של FADH2 תורמת 2 אלקטרונים לשרשרת הנשימה ומתקבלות 1.5 מולקולות של ATP במעבר של האלקטרונים לחמצן. כל מולקולה של NADH תורמת 2 אלקטרוני לשרשרת הנשימה ומתקבלות 2.5 מולקולות של ATP. מכאן שלכל סבב של חימצון בטא מתקבלות 4 מולקולות (1.5+2.5) של ATP כתוצאה מנשאי האלקטרונים.
acetyl-CoA נכנס למעגל קרבס, בכל סבב במעגל נוצרים: 3 NADH, ATP ו-FADH2. לאחר מעבר נשאי האלקטרונים בשרשרת הנשימה מתקבלות עוד 9 מולקולות ATP. סך הכללכל מולקולת acetyl-CoA מתקבלות 10 מולקולות ATP.
חומצות שומן בלתי רוויות שנצרכות מהטבע הן בקונפיגורציה cis. בתהליך חימצון בטא של חומצת שומן רוויה, התוצר של הריאקציה הראשונה הוא בקונפיגורציה trans והאנזים הפועל עליו בריאקציה השנייה (enoyl-CoA hydratase) לא יכול לעבוד על חומצות שומן בקונפיגורציה cis. יש צורך בשני אנזימים נוספים- איזומראז (isomerase) ורדוקטאז (reductase). חומצות שומן עם קשר אחד כפול דורשות את האיזומראז על מנת להמיר את הקשר הכפול ל-trans, ולאחר מכן התוצר מדלג על הריאקציה הראשונה של חימצון בטא ועובר לריאקציה השנייה. בצורה זו אין יצירה של FADH2 באחד הסבבים בחימצון בטא של חומצת שומן עם קשר כפול אחד ולכן יוצרת פחות 1.5 מולקולות של ATP מחומצת שומן רוויה באותו אורך.
חומצות שומן עם שני קשרים כפולים דורשות את האיזומראז וגם את הרדוקטאז. רדוקטאז דורש NADPH לפעילותו. שילוב הפעולה של שניהם מאפשרת המשך של חומצת השומן בחימצון בטא. חומצת שומן עם שני קשרים כפולים לא מייצרת FADH2 בסבב אחד ובנוסף דורשת NADPH בסבב נוסף ולכן יוצרת פחות 4 מולקולות של ATP מחומצת שומן רוויה באותו אורך (הדרישה של NADPH והייצור של NADH + H+ באותו סבב מבטלים אחד את השני).
חישוב מהיר-
אנו יודעים שכל מולקולת Acetyl-CoA, FADH2 או NADH+ H+ מניבות מספר מסוים של מולקולות ATP. לכן חישוב מספר מולקולות אלה שווה למספרמולקולות ה-ATP שייצרו (ככל שיש יותר מהן, ייווצרו יותר מולקולות ATP).
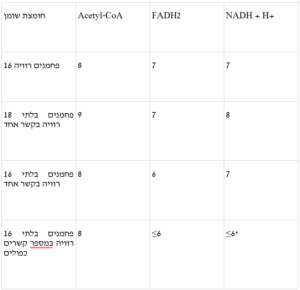
*השימושב- NADPH הוקבל בחישוב לחוסר ייצור של NADH + H+.
ניתן להגיד מחישוב זה שהמולקולה שתניב את מספר מולקולות ה-ATP הגדול ביותר היא חומצת השומן של 18 פחמנים שהינה בלתי רוויה בקשר כפול אחד.
חישוב מפורט-
לחומצת השומן של 16 פחמנים שהינה רוויה יש צורך ב-7 סבבים של חימצון בטא כדי לפרק אותה ל-8 מולקולות של acetyl-CoA, 7 FADH2, 7 NADH +H+. סך הכל, חימצון בטא של חומצת שומן זו מניב 108 מולקולות ATP: 80 מולקולות ATP מ-8acetyl-CoA, ו- 28 מולקולות ATP מ- 7 FADH2 ו- 7 NADH + H+.
לחומצת השומן של 18 פחמנים שהינה בלתי רוויה בקשר כפול אחד יש צורך ב-8 סבבים של חימצון בטא כדי לפרק אותה ל-9 מולקולות של acetyl-CoA, 7 FADH2, 8 NADH + H+. סך הכל, חימצון בטא של חומצת שומן זו מניב 120.5 מולקולות ATP: 90 מולקולות ATP מ-9 acetyl-CoA, ו- 30.5 מולקולות ATP מ- 7 FADH2 ו- 8 NADH +H+.
לחומצת השומן של 16 פחמנים שהינה בלתי רוויה בקשר כפול אחד יש צורך ב-7 סבבים של חימצון בטא כדי לפרק אותה ל-8 מולקולות של acetyl-CoA, 6 FADH2, 7 NADH + H+. סך הכל, חימצון בטא של חומצת שומן זו מניב 106.5 מולקולות ATP: 80 מולקולות ATP מ-8 acetyl-CoA, ו- 26.5 מולקולות ATP מ- 6 FADH2 ו- 7 NADH +H+.
לחומצת השומן של 16 פחמנים שהינה בלתי רוויה במספר קשרים כפולים (לצורך החישוב נניח שמדובר ב-2 קשרים כפולים) יש צורך ב-7 סבבים של חימצון בטא כדי לפרק אותה ל-8 מולקולות של acetyl-CoA, 6 FADH2, 6 NADH +H+*. סך הכל, חימצון בטא של חומצת שומן זו מניב104 מולקולות ATP: 80 מולקולות ATP מ-8acetyl-CoA, ו- 24 מולקולות ATP מ- 6 FADH2 ו- 6 NADH +H+.
להרחבה- Lehninger,מהדורה שישית, עמודים 673-675 (חימצון בטא), 677 (חימצון בטאלחומצות שומן בלתי רוויות).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן.
להרחבה- Lehninger, מהדורה שמינית, פרק 17, עמודים 2200-2204 (חימצון בטא), 2212-2216 (חימצון בטא של חומצות שומן בלתי רוויות).
ביוכימיה 5 שאלה 10
רובו המוחלט של החמצן הנצרך בנשימה מומר ל:
במה השאלה עוסקת: זירחון חימצוני-oxidativephosphorylation –
תשובה ד. אנו זקוקים לחמצן על מנת ליצור ATP שישמש כאנרגיה זמינה בגוף. יצירת ATP מתרחשת בממברנה הפנימית של המיטוכונדריה בתהליך הנשימה התאית. תהליך זה כולל שרשרת מעבר אלקטרונים וזירחון ליצירת ATP. שרשרת מעבר האלקטרונים כוללת 4 קומפלקסים שיושבים על הממברנה הפנימית של המיטוכונדריה ומשמשים כנשאי אלקטרונים. האלקטרונים נתרמים מנשאי האלקטרונים NADH ו-FADH2 שמיוצרים בתהליכי קטבוליזם שלגלוקוז וחומצות שומן. אלקטרונים אלה מועברים בקומפלקסים במיטוכונדריה והאנרגיה הנוצרת משמשת למעבר של פרוטונים מהמטריקס למרווח הבין ממברנלי של המיטוכונדריה. כךנוצר הבדל בריכוזי הפרוטונים ובמטענים בין שני צידי הממברנה הפנימית של המיטוכונדריה (המרווח הבין ממברנלי בעל יותר פרוטונים ועל כן חיובי יותר מהמטריקס) ובזכות כך נוצרת אנרגיה אלקטרוכימית שמשמשת ליצירת ATP. חמצן דרוש להתרחשות הנשימה התאית מכיוון שמשמש כקולט האלקטרונים האחרון בשרשרת מעבר האלקטרונים. בזכות מעבר של 4 אלקטרונים לחמצן בקומפלקס 4, מתקבלות 2 מולקולות H2O.
שלילת מסיחים:
א. אצטיל קו-A (acetyl-CoA) היא מולקולה שנוצרת בתהלי כיפירוק של חומצות שומן (חימצון בטא) וסוכרים (דה-קרבוקסלציה חימצונית, oxidative decarboxylation, ע”י Pyruvate dehydrogenase complex, PDH). חמצן מעורב בפירוק חומצות שומן בפרוקסיזומים (peroxisomes), תהליך המתרחש מעט יחסית ביונקים ולכן אינו התהליך העיקרי שחמצן משמש לו. בתהליך זה חמצן הופך ל-H2O2 לאחר קבלת 2 אלקטרונים. בנוסף חמצן מעורב בתהליך חימצון אומגה (w oxidation) שמתרחש ב-ER של תאי כבד וכליה. פירוק חומצות שומן בתהליך זה מתרחש בפחמן w שהוא הרחוק ביותר מקבוצת הקרבוקסיל. חמצן משמש בתהליך זה ליצירת קבוצת הידרוקסיל (OH) על פחמן w. תהליך חימצון אומגה הוא מינורי לעומת חימצון בטא ולכן אינו התפקיד העיקרי של חמצן שנצרך בנשימה.
ב. פחמן דו חמצני נוצר בתהליך פירוק של שלדים פחמימניים כמו סוכרים (גליקוליזה, דה-קרבוקסילציה חימצונית ומעגל קרבס), חומצות שומן (חימצון אלפא-חימצון חומצות שומן מסועפות בפרוקסיזום) וחומצות אמינו. בכל התהליכים האלו חמצן אינו המקור לפחמן דו חמצני אלא השלד הפחמימני.
ג. פחמן חד חמצני לא הופך לפחמן דו חמצני בגוף.
להרחבה- Lehninger,מהדורה שישית, עמודים 634-637 (PDH), 673-675 (חימצון בטא), 682 (חימצון בטא בפרוקסיזומים), 684-685(חימצון אומגה), 685-686 (חימצון אלפא), 710 (פירוק חומצות אמינו), 737-745(זירחון לחמצוני).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר האלקטרונים+ סינתזת ATP.
להרחבה- Lehninger,מהדורה שמינית, פרק 16- עמודים 2091-2100 , פרק 17- 2200-2204 (חימצון בטא), 2232-2233 (חימצון בטא בפרוקסיזומים), 684-685 (חימצון אומגה- מהדורה 6), 2235-2237 (חימצון אלפא), פרק 18- 2265-2267 (פירוק חומצות אמינו), פרק 19- 2377-2405 (זירחון חמצוני).
ביוכימיה 5 שאלה 11
מי מנשאי האלקטרונים הבאים אינו מסוגל להעביר אלקטרון יחיד בכל פעם?
במה השאלה עוסקת: נשאי אלקטרונים.
תשובה א. מספר רב של אנזימים המזרזים תהליכי חימצון מנתבים את האלקטרונים מהסובסטרטים השונים שלהם למספר מצומצם של נשאי אלקטרונים. חיזור נשאי האלקטרונים הללו שומר על האנרגיה החופשית המשתחררת מפירוק קשרים כימיים במולקולות שעוברות תהליכים קטבוליים (גליקוליזה, מעגל קרבס, חימצון בטא ועוד). NAD ו-NADP נעים מאנזים אחד לשני כאשר האנזימים שנעזרים בהם נקראים דהידרוגנז (dehydrogenase), FAD ו-FMN בדרךכלל קשורים לאנזימים שנקראים flavoproteins כקבוצות פרוסטטיות. ubiquinone (Q) הוא נשא מסיס בשומן לעומת השניים הקודמים שמסיסים במים. Q מעביר אלקטרונים בתוך ממברנות.
NADH ו-NADPH עוברים חיזור בטבעת ניקוטינאמיד (nicotinamide) שמרכיבה אותם. כאשר סובסטרט כלשהו של אנזים דהידרוגנז עובר חימצון, הוא מוסר שני אלקטרונים ופרוטון (נקראים גם יון הידריד, hydride ion) ל-NAD או NADP.
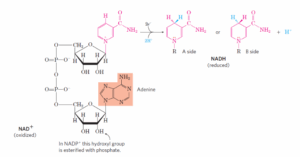
שלילת מסיחים:
ב, ג. FMN ו-FAD הם שניהם flavin nucleotides שמשמשים קו-אנזימים ל-flavoproteins. הטבעת isoalloxazine בנשאים אלו יכולה להיות מחוזרת ע”י אלקטרון אחד או שניים בצורת פרוטון אחד או שניים. בצורה המחוזרת ביותר הנשאים נקראים FADH2 ו-FMNH2. כאשר הנשאים מחוזרים ע”י אלקטרון אחד, מצב הטבעת נקרא semiquinone ומסומן כך- FADH● ו-FMNH●.
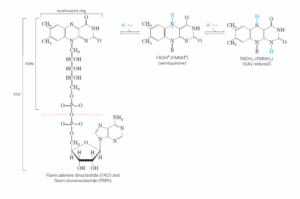
ד. Q יכול להיות מחוזר ע”י אלקטרון אחד ולהפוך ל-semiquinone radical ●QH)), או להיות מחוזר ע”י 2 אלקטרונים ליצירת ubiquinol (QH2).
להרחבה- Lehninger, מהדורה שישית, עמודים 533-535 (NAD, NADP, FAD, FMN), 735 (ubiquinone).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר האלקטרונים.
להרחבה- Lehninger, מהדורה שמינית, פרק 19, 13, עמודים 1807-1816 (NAD, NADP, FAD, FMN), 2373, (ubiquinone).
ביוכימיה 5 שאלה 12
תרכובת חדשה בודדה מהמיטוכונדריה ונטען כי היא מייצגת נשא אלקטרונים שלא זוהה עד כה, המשתתף בשרשרת מעבר האלקטרונים, וניתן לו השם “קו-אנזים Z”. מי מבין העובדות הבאות, לדעתך, אינה מספיקה על מנת להניח כי קו-אנזים זה מהווה חלק משרשרת מעבר האלקטרונים?
במה השאלה עוסקת: שרשרת מעבר האלקטרונים.
תשובה ד. שרשרת מעבר האלקטרונים מורכבת מסדרה של נשאי אלקטרונים הפועלים אחד אחרי השני בתהליך. מעבר אלקטרונים דרכם הוא תהליך אקסרגוני (ΔG<0) שהאנרגיה הנוצרת בו מנוצלת למעבר פרוטונים למרווח הבין ממברנלי. הפרש הריכוזים והמטענים שנוצר בעקבות מעבר הפרוטונים מנוצל ליצירת אנרגיה זמינה בצורת ATP. לנשאי האלקטרונים הפועלים בשרשרת הנשימה יש תכונות דומות שהכרחיות להשתתפותם בשרשרת הנשימה. תכונה אחת כזו היא נוכחותם של נשאי האלקטרונים בממברנה הפנימית של המיטוכונדריה. לכן אם נשאי האלקטרונים יוספו לתרחיף מיטוכונדריה (תמיסה בה חלבונים וחלקיקי ממברנות של המיטוכונדריה מפוזרים בתוך נוזל המיטוכונדריה בעל צפיפות נמוכה יותר) הם ייצרכו ספציפית על ידה. אך בנוסף לנשאי האלקטרונים הספציפיים למיטוכונדריה, ישנם חלבונים נוספים שגם הם ספציפיים למיטוכונדריה ומשתתפים בתהליכים אחרים המתרחשים בה (חמצון חומצות שומן, מעגל קרבס, מעגל האוריאה). לכן העובדה שקו-אנזים Z נצרך ספציפית ע"י המיטוכונדריה אינה מספיקה על מנת להניח כי הוא מהווה חלק משרשרת מעבר האלקטרונים.
שלילת מסיחים:
א. בריאקציה הכוללת של שרשרת הנשימה, אלקטרונים מועברים מתורם אלקטרונים ראשוני כמו NADH, דרך מספר נשאים בממברנה הפנימית של המיטוכונדריה עד ל-O2. אם אחד מהנשאים מוסר ממברנת המיטוכונדריה או מעוכב ע"י חומר מסוים, צריכת החמצן יורדת. לכן העובדה שצריכת חמצן יורדת כאשר קו-אנזים Z מוסר ממברנת המיטוכונדריה מאששת את ההנחה שהוא מהווה חלק משרשרת מעבר האלקטרונים.
ב. קצב חמצון חיזור של נשאי האלקטרונים קובע את קצב מעבר האלקטרונים בהם וכך גם את קצב צריכת החמצן לתהליך. הריאקציה האיטית ביותר בתהליך תהיה שלב קובע המהירות של התהליך כולו. שרשרת מעבר האלקטרונים קובעת את קצב צריכת החמצן ומהווה שלב קובע מהירות בתהליך הזירחון החימצוני (Oxidative Phosphorylation). לכן נשא שמשתתף בשרשרת מעבר האלקטרונים עובר חמצון חיזור בקצב התואם את קצב צריכת החמצן שמצביע על קצב מעבר האלקטרונים בשרשרת. תכונה זו של קו-אנזים Z מאששת את ההנחה שהוא מהווה חלק משרשרת מעבר האלקטרונים וכך קובע את קצב צריכת החמצן בתהליך.
ג. הוספת מעכבים של שרשרת מעבר האלקטרונים תוקעת את השרשרת וגורמת להצטברות נשאי אלקטרונים מחוזרים לפני נקודת העיכוב ונשאי אלקטרונים מחומצנים אחריה. CN מעכב את קומפלקס 4 ולכן כל נשאי האלקטרונים בשרשרת עד לנקודה זו ישארו מחוזרים או במילים אחרות קצב החמצון שלהם ירד.
להרחבה- Lehninger, מהדורה שישית, 531 (פוטנציאל חיזור) 737 (סדר נשאי האלקטרונים) ,748-749 (הקשר בין צריכת חמצן לשרשרת מעבר האלקטרונים).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר האלקטרונים.
להרחבה- Lehninger, מהדורה שמינית, פרק 14, 1978-1801 (פוטנציאל חיזור), פרק 19, 2376 (סדר נשאי האלקטרונים) ,2408-2413 (הקשר בין צריכת חמצן לשרשרת מעבר האלקטרונים).
ביוכימיה 5 שאלה 13
אנטימיצין antimycin A) A) חוסם את שרשרת מעבר האלקטרונים בין ציטוכרום b וציטוכרום c1 .
מי מהבאים ימצא בצורתו המחומצנת, כאשר מיטוכונדריה מודגרת (incubated) עם אנטימיצין A, עודף NADH וחמצן?
במה השאלה עוסקת: שרשרת מעבר האלקטרונים.
תשובה ב. שרשרת מעבר האלקטרונים מורכבת מסדרה של נשאי אלקטרונים הפועלים אחד אחרי השני בתהליך, רובם חלבונים אינטגרליים בעלי קבוצות פרוסטטיות שמקבלות ומוסרות אלקטרונים. ישנם חלבונים שנקראים flavoproteins בעלי FAD או FMN כקבוצות פרוסטטיות, שניהם flavinnucleotides. יש חלבונים בעלי קומפלקסים של ברזל וסולפט ויש חלבונים שנקראים ציטוכרום (cytochrome, cyt) שהם בעלי בליעה חזקה של אור בזכות הקבוצה הפרוסטטית שלהם- קבוצת ה-heme בעלת אטום הברזל. ישנם 3 סוגים שלציטוכרומים במיטוכונדריה- a, b, c ששונים בספקטרום האור שהם בולעים. חלבון אחד מתוך הציטוכרומים שנקרא ציטוכרום c הינו חלבון מסיס שעובר אינטראקציה אלקטרוסטטית עם הצד החיצוני של הממברנה הפנימית של המיטוכונדריה. מלבד נשאים אלה, קיים נשא הידרופובי שנקרא ubiquinone (Q) שמעביר אלקטרונים תוך תנועה בממברנה שלהמיטוכונדריה.
חלק מנשאי האלקטרונים של שרשרת הנשימה מאורגנים בתוך קומפלקסים המעוגנים בממברנת המיטוכונדריה. קומפלקס 1 מקבל אלקטרונים מ-NADH שמגיע מתהליכים קטבולים בתא (גליקוליזה, מעגל קרבס, חימצון בטא עוד), ומוסר אותם ל-Q. קומפלקס 2 מקבל אלקטרונים מ-succinate במעגל קרבס ומוסר גם הוא ל-Q. קומפלקס 3 מקבל אלקטרונים מ-QH2 (Q מחוזר ב-2 אלקטרונים) ומוסר אותם ל-cyt c דרך cyt b ו- cyt c1 שמחוברים אליו כקבוצות פרוסטטיות. קומפלקס 4 מקבל אלקטרונים מ- cyt c ומעברי ל-O2 דרך cyt a ו- cyt a3 שמחוברים אליו כקבוצות פרוסטטיות.
סדר מעברהאלקטרונים בנשאים:
NADH/succinate > Q > cyt b > cyt c1 > cyt c > cyt a > cyt a3 > O2
סדר זה נקבע על פי ערך פוטנציאל החיזור של נשאי האלקטרונים, המעבר הוא מנשאים בעלי פוטנציא לחיזור נמוך לנשאים בעלי פוטנציאל חיזור גבוה. ערכי פוטנציאל החיזור של הנשאים הם ערכים אמפיריים (נקבעו בעקבות ביצוע ניסוי).
כאשר משתמשים באנטיביוטיקה אנטימיצין A (antimycin A), יש חסימה של מעבר האלקטרונים בין cyt b ל- cyt c1. שני ציטוכרומים אלו הם קבוצות פרוסטטיות של קומפלקס 3, על כן אנטיביוטיקה זו מונעת את פעולתו. כאשר יש חסימה של מעבר האלקטרונים בנשאים מסוימים, אך יש עודף של מוסר אלקטרונים כמו NADH ועודף של מקבל אלקטרונים O2, הנשאים שלפני החסימה יהיו מחוזרים והנשאים לאחר החסימה יהיו מחומצנים. זאת מכיוון שהאלקטרונים יעברו מ-NADH לנשא המקבל וימשיכו לעבור בין הנשאים ולחזר אותם עד לנשא החסום. הנשאים שאחרי החסימה יפסיקו לקבל אלקטרונים, האלקטרונים שקיבלו לפני השימוש באנטימיצין יעברו לחמצן וכך נשאים אלו יהפכו למחומצנים.
החסימה של קומפלקס 3 ע”י אנטימיצין A גורמת לנשא cyt a3 שמצוי בקומפלקס 4 להיות במצב מחומצן מכיוון שלא מקבל אלקטרונים מהנשאים לפניו.
שלילת מסיחים:
א. Q מוסר את האלקטרונים לקומפלקס 3, על כן נמצא לפני החסימה ויהיה מחוזר.
ג. cyt b מצוי בקומפלקס 3 ואנטימיצין A מונע את מעבר האלקטרונים בינו לבין הנשא הבא אחריו- cyt c1. על כן cytb יהיה מחוזר לאחר החסימה.
ד. ישנם 3 סוגים של ציטוכרומים במיטוכונדריה- a, b, c ששונים בספקטרום האור שהם בולעים. מכאן שלא קיים ציטוכרום f.
להרחבה- Lehninger,מהדורה שישית, עמודים 735-743 (נשאי אלקטרונים והקומפלקסיםשל שרשרת הנשימה).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר האלקטרונים.
להרחבה- Lehninger, מהדורה שמינית , פרק 19, עמודים 2372-2394 (נשאי אלקטרונים והקומפלקסים של שרשרת הנשימה).
ביוכימיה 5 שאלה 14
מי מהבאים אינו יוצר QH2 מחוזר באופן קבוע?
במה השאלה עוסקת: שרשרת מעבר האלקטרונים.
תשובה ג. שרשרת מעבר האלקטרונים מורכבת מסדרה של נשאי אלקטרונים הפועלים אחד אחרי השני בתהליך. אחד הנשאים הוא נשא הידרופובי שנקרא ubiquinone (Q) שמעביר אלקטרונים תוך תנועה בממברנה של המיטוכונדריה. Q יכול להיות מחוזר ע”י אלקטרון אחדו להפוך ל-semiquinone radical ●QH)), או להיות מחוזר ע”י 2 אלקטרונים ליצירת ubiquinol (QH2). נשא זה מקבל אלקטרונים ב-4 דרכים שונות:
1. קומפלקס I שמקבל 2 אלקטרונים מ-NADH ומעביר אותם ל-Q ליצירת QH2.
2. קומפלקס II שמקבל 2 אלקטרונים מ-succinate ומעביר אותם ל-Q ליצירת QH2.
3. glycerol 3-phosphate dehydrogenase שמקבל 2אלקטרונים מ-glycerol 3-phosphate ומעביראותם ל-Q ליצירת QH2.
4. acyl-CoA dehydrogenase שמקבל אלקטרונים מחומצת שומן ומעביר ל-Q ליצירת QH2. אנזים זה הוא הראשון בחימצון בטא (פירוק חומצות שומן). הוא מעביר את האלקטרונים מחומצת השומן לחלבון flavoprotein (חלבון שיש לו FAD/FMN בתור קבוצה פרוסטטית) שמעביר לחלבון נוסף שהוא flavoprotein בעל מרכז Fe-S וחלבון זה מעביר ל-Q.
קומפלקס III נקרא גם ubiquinone :cytochrome c oxidoreductase מקבל אלקטרונים מ-QH2 ומעביר אותם ל-cyt c בשרשרת מעבר האלקטרונים. לכן קומפלקס זה לא יוצר QH2 ע”י חיזור ציטוכרום C. שימו לב כי במעגל Q כן נוצר QH2 אך הוא לא תוצאה ישירה של חיזור הציטוכרום, ומתרחש רק בחצי המחזור השני של המעגל (ולא לכל אורך המחזור).
שלילת מסיחים:
א. קומפלקס I שנקראגם NADH dehydrogenase הוא קומפלקס חלבוני המצוי על הממברנה הפנימית של המיטוכונדריה ומשתתף בשרשרת מעבר האלקטרונים. הקומפלקס מקבל 2 אלקטרונים מ-NADH שמגיע מתהליכים קטבולים בתא ומעביר אותם ל-Q ליצירת QH2. שני האלקטרונים נקלטים תחילה ב-FMN שקשור לאחד החלבונים בקומפלקס. לאחר מכן כל אלקטרון בנפרד מועבר דרך מספר מרכזי Fe-S (קבוצות פרוסטטיות בחלבונים בקומפלקס) עד העברתו ל-Q.
ג. קומפלקס II שנקרא גם succinate dehydrogenase משתתף בשרשרת מעבר האלקטרונים ובמעגל קרבס. הקומפלקס מקבל שני אלקטרונים מ-succinate שהופך ל-fumarate. האלקטרונים נקלטים ע”י FAD שקשור לאחד החלבונים בקומפלקס, ממנו כל אלקטרון בנפרד מועבר דרך מספר מרכזי Fe-S עד העברתו ל-Q.
ד. glycerol 3-phosphate dehydrogenase מצוי בצד החיצוני של הממברנה הפנימית של המיטוכונדריה. הוא מעביר את האלקטרונים מ-glycerol 3-phosphate ל-Q דרך FAD שמצוי בו כקבוצה פרוסטטית. glycerol 3-phosphate נוצר מגליצרול שמשוחרר מפירוק של triacylglycerol או בחיזור של dihydroxyacetone phosphate שהוא תוצר בגליקוליזה.
להרחבה- Lehninger,מהדורה שישית, 735-741 (שרשרת מעבר האלקטרונים).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר האלקטרונים.
להרחבה- Lehninger, מהדורה שמינית, פרק 19, 2372-2389 (שרשרת מעבר האלקטרונים).
ביוכימיה 5 שאלה 15
בחמצון של QH2 ע”י יוביקווינון- ציטוכרום C רדוקטאז ( ubiquinone-cytochrome c reductase, קומפלקס III ) בתאי שריר לב, מהי הסיבה שנדרשים 2 מול של ציטוכרום C עבור מול אחד של QH2 בסטוכיומטריית התגובה?
במה השאלה עוסקת: שרשרת מעבר האלקטרונים.
תשובה א. שרשרת מעבר האלקטרונים מורכבת מסדרה של נשאי אלקטרונים הפועלים אחד אחרי השני בתהליך. אחד הנשאים הוא קומפלקס III שנקרא גם ubiquinone :cytochrome c oxidoreductase. קומפלקס זה מקבל אלקטרונים מנשא האלקטרונים השומני ubiquinol (QH2) ומעביר אותם ל-cyt c בשרשרת מעבר האלקטרונים. ubiquinol נושא שני אלקטרונים ו- cyt c נושא רק אלקטרון אחד ולכן יש צורך ב-2 מולשל cyt c על מנת לקבל את כל האלקטרונים ממול אחד של QH2.
שלילת מסיחים:
ב. ההיפך הוא הנכון. cyt c מקבל אלקטרון אחד בלבד ו-QH2 תורם 2 אלקטרונים.
ג. cyt c הוא חלבון מסיס שמצוי במרווח הבין ממברנלי ויוצר קשרים אלקטרוסטטים עם החלבונים בממברנה הפנימית של המיטוכונדריה. לאחר שקבוצת ה-heme שמצויה בו כקבוצה פרוסטטית מקבלת אלקטרון אחד מקומפלקס III, cyt c נע לעבר קומפלקס IV ומוסר את האלקטרונים שלו. הסיבה שיש צורך ב-2 מול של cyt c לכל מול של QH2 אינה שהוא מסיס ומצוי במרווח הבין ממברנלי, אלא שהוא יכול לקבל רק אלקטרון אחד בכל עם בעוד ש-QH2 מוסר שני אלקטרונים.
ד. שריר הלב אכן מבצע מטבוליזם חמצוני בקצב גבוה ולכן זקוק לכמויות גדולות של מיטוכונדריה בתאים שלו (מאות או אלפים). הסיבה שיש צורך ב-2 מול של cyt c לכל מול של QH2 אינה תלויה בקצב המטבוליזם החמצוני, אלא ביכולת של cyt c לקבל רק אלקטרון אחד לעומת Q שתורם שניים.
להרחבה- Lehninger,מהדורה שישית, עמודים 740-742 (קומפלקס III ש שרשרת מעבר האלקטרונים).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר האלקטרונים.
להרחבה- Lehninger,מהדורה שמינית, פרק 19, עמודים 2386-2390 (קומפלקס III שרשרת מעבר האלקטרונים).
ביוכימיה 5 שאלה 16
מה מהבאים אינו מאפיין של קומפלקס IV ?
במה השאלה עוסקת: שרשרת מעבר האלקטרונים.
תשובה ד. שרשרת מעבר האלקטרונים מורכבת מסדרה של נשאי אלקטרונים הפועלים אחד אחרי השני בתהליך, רובם חלבונים אינטגרליים בעלי קבוצות פרוסטטיות שמקבלות ומוסרות אלקטרונים. חלק מנשאי האלקטרונים של שרשרת הנשימה מאורגנים בתוך קומפלקסים המעוגנים בממברנה. קומפלקס IV הוא הקומפלקס האחרון בשרשרת ומעביר את האלקטרונים המגיעים אליו מ-cytochrome c (cyt c, נשא מסיס בעל קבוצת heme שמעביר אלקטרון אחד בכל פעם) ל-O2 וכך יוצר 2 מולקולות H2O. קומפלקס זה בעל מספר קבוצות פרוסטטיות חשובות, ביניהן cyt a ו- cyt a3 בעלות קבוצת heme שמאפשרת קליטת אלקטרון. קבוצות פרוסטטיות חשובות נוספות בקומפלקס IV הן קומפלקסים של נחושת (Cu) וקבוצת תיול (SH) של שיירי ציסטאין (Cys, Cysteine) שמתפקדים בדומה לקומפלקסים של ברזל וגופרית (Fe-S) – קולטים אלקטרונים. CuA הוא יון שיוצר מרכז קולט אלקטרונים יחד עם cys ו- CuB הוא יון שיוצר מרכז קולט אלקטרונים יחד עם cyt a3. האלקטרונים נעים מ- cyt c למרכז CuA, משם הם נעים ל- cyt a ולמרכז CuB-cyta3 ולבסוף ל- O2. לכל 4 אלקטרונים הנקלטים בקומפלקס, 4 פרוטונים מהמטריקס משמשים ליצירת 2 מולקולות של H2O יחד עם חמצן. בנוסף לפרוטונים אלו, 4 פרוטונים נוספים נשאבים מהמטריקס למרווח הבין ממברנלי בזכות האנרגיה המשתחררת מהחיזור של חמצן.
כל התהליך כולל מרכזי חימצון חיזור שקולטים אלקטרון אחד בלבד בכל פעם וקיימת סכנה ליצירת תוצרים רדיקלים (שאינם מחוזרים במלואם) כמו H2O2 או הידרוקסיל. חומרים אלה יכולים להזיק לתא כי הם מאוד פעילים ויכולים לתקוף מקרו מולקולות כמו הדנ”א. לכן תוצרי הביניים קשורים היטב לקומפלקס IV עד שהם מומרים באופן מלא ל- H2O. קומפלקס IV לא עובר 2 מחזורים קטליטיים ליצירת 2 מולקולות H2O אלא רק מחזור אחד שכולל מולקולת O2 אחת ועוד 4 אלקטרונים מ- cyt c.
שלילת מסיחים:
א. cyt c הוא נשא אלקטרונים מסיס שנע בין קומפלקס III ל- IV ומעביר אלקטרון אחד ביניהם בכל פעם.
ב. נחושת Cu חשובה בקומפלקס IV למעבר האלקטרונים. היא קיימת בשני מרכזים חשובים לקליטת אלקטרונים בתהליך, אחד יחד עם גופרית בדומה לברזל והשני באינטראקציה עם קבוצת ה-heme ב- cyt a3.
ג. 4 פרוטונים מהמטריקס משמשים ליצירת 2 מולקולות מים ו-4 פרוטונים נשאבים למרווח הבין ממברנלי לכל 4 אלקטרונים שנקלטים בקומלקס IV. לכן לכל אלקטרון נצרכים 2 פרוטונים מהמטריקס.
להרחבה- Lehninger, מהדורה שישית, עמודים 742-743 (שרשרת מעבר האלקטרונים-קומפלקס IV).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר האלקטרונים.
להרחבה- Lehninger, מהדורה שמינית, פרק 19, עמודים 2390-2394 (שרשרת מעבר האלקטרונים-קומפלקס IV).
ביוכימיה 5 שאלה 17
מה מהבאים אינו נכון בנוגע לכוח המניע של הפרוטונים?
במה השאלה עוסקת: שרשרת מעבר האלקטרונים.
תשובה ג. המעבר של 2 אלקטרונים מ-NADH, דרך שרשרת מעבר האלקטרונים ועד לחמצן הוא תהליך מאוד אקסרגוני. ניתן לחשב את האנרגיה המשתחררת בתהליך בעזרת פוטנציאל החיזור הסטנדרטי (E’˚) של חצאי התגובות (תגובות החיזור בתגובת חימצון-חיזור מלאה) NAD+ ל-NADH ו- O2 ל- H2O. פוטנציאל זה מסמן את האפיניות לאלקטרונים של החומר המחמצן בריאקציה. אלקטרונים נוטים לנוע בכיוון החומר בעל פוטנציאל החיזור הגבוה יותר. תנועה זו היא ספונטנית והאנרגיה הנוצרת כתוצאה ממנה פרופורציונאלית להפרש בפוטנציאל החיזור בין המחזר למחמצן (ΔE’˚= E’˚ electron acceptor- E’˚ electron donor). מעבר של אלקטרונים מ- succinate לחמצן הוא תהליך אקסרגוני גם כן, אם כי האנרגיה המשתחררת קטנה יותר. האנרגיה מתהליכי החיזור הללו משמשת בשרשרת הנשימה למעבר של פרוטונים נגד מפל הריכוזים שלהם, מהמטריקס למרווח הבין ממברנלי של המיטוכונדריה.
לכל 2 אלקטרונים המועברים לחמצן, 4 פרוטונים מועברים בקומפלקס I, 4 בקומפלקס II, 4 בקומפלקס III ו-2 בקומפלקס IV. האנרגיה האלקטרוכימית המתקבלת מההפרש בריכוזים ובמטענים שנוצר בין צידי הממברנה, היא שימור זמני של האנרגיה שנוצרה ממעבר האלקטרונים בשרשרת הנשימה. אנרגיה זו נקראת proton-motive force (כוח אלקטרו-מניע) ובעלת שני מרכיבים: מרכיב כימי שנוצר כתוצאה מהפרש בריכוזי הפרוטונים, והמרכיב החשמלי שנוצר כתוצאה מהפרש מטענים כאשר פרוטונים, שהם יונים חיוביים, יוצרים סביבה חיובית יותר במרווח הבין ממברנלי.
succinate היא מקור לאלקטרונים שעוברים בשרשרת הנשימה אך אינה המקור היחיד. לכן אינה נדרשת לשם יצירת הכוח המניע במיטוכונדריה.
שלילת מסיחים:
א. אחד ממרכיבי הכוח המניע הינו מרכיב כימי של הפרש ריכוזי הפרוטונים.
ב. אחד ממרכיבי הכוח המניע הינו מרכיב חשמלי של הפרש במטענים שנוצר כתוצאה ממעבר הפרוטונים החיוביים בין צידי הממברנה.
ד. הכוח המניע נוצר כתוצאה ממעבר הפרוטונים בממברנה בזכות מעבר האלקטרונים בשרשרת מעבר האלקטרונים.
להרחבה- Lehninger, מהדורה שישית, עמודים 530 (פוטנציאל חיזור סטנדרטי), 743-744(האנרגיה של שרשרת מעבר האלקטרונים).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר האלקטרונים.
להרחבה- Lehninger, מהדורה שמינית, פרק 13- עמודים 1796-1797 (פוטנציאל חיזור סטנדרטי), פרק 19- 2398-2401 (האנרגיה של שרשרת מעבר האלקטרונים).
ביוכימיה 5 שאלה 18
ציאניד (cyanide), אוליגומיצין (oligomycin), ו- 2,4 -דיניטרופנול (2,4-dinitrophenol) הם מעכבים של פוספורילציה אירובית במיטוכונדריה. מה מהבאים מתאר נכון את פעולת המעכבים האלו?
במה השאלה עוסקת: זירחון חימצוני- oxidative phosphorylation.
תשובה ב. לקומפלקסים המרכיבים את שרשרת מעבר האלקטרונים ול-ATP synthase, יש חומרים שונים המעכבים אותם. בזכות שימוש בחומרים אלו מדענים חקרו את הצימוד בין חימצון בשרשרת מעבר האלקטרונים לזירחון בעת ייצור ATP. ציאניד (cyanide) הוא חומר המעכב את קומפלקס IV בשרשרת הנשימה וכך מונע מעבר של אלקטרונים לחמצן. כתוצאה מכך כל הקומפלקסים נשארים במצב מחוזר והמער של פרוטונים מהמטריקס למרווח הבין ממברנלי פוסק. אוליגומיצין (oligomycin) היא אנטיביוטיקה שנקשרת ל- ATP synthase ומעכבת אותו וכך אין ייצור של ATP. 2,4-דיניטרופנול (2,4- dinitrophenol, DNP) מפר את הצימוד בין חימצון (שרשרת הנשימה) לזירחון (ייצור ATP ע”י ATP synthase) ע”י כך שמעביר פרוטונים בין צדי הממברנה במורד הגרדיינט. חומר זה הוא חומצה חלשה והידרופובית ועל כן יכול לעבור את הממברנה הפנימית של המיטוכונדריה, לקשור פרוטון ולהעביר אותו למטריקס. בצורה כזו הוא מפר את גרדיינט הפרוטונים ומעכב את ATP synthase.
שלילת מסיחים:
א. DNP מעכב את ייצור ה-ATP, הוא אינו מונע פעילות של שרשרת מעבר האלקטרונים.
ג. ציאניד מעכב את קומפלקס IV (cytochrome oxidase) וכך מונע מעבר של אלקטרונים לחמצן, ייתכן והדרך שהוא עושה זאת היא ע”י תחרות עם חמצן על הקשירה לקומפלקס IV (למרות שאין ציון לכך בספר). אוליגומיצין ו-DNP לא מתחרים עם חמצן על קשירה לקומפלקס IV אלא הם מעכברים תהליכים בזירחון חימצוני. ראה פירוט לעיל.
ד. אוליגומיצין מעכב ייצור ATPע”י קשירה ל- ATP synthase.
להרחבה- Lehninger, מהדורה שישית, עמודים 748 (חקר הצימוד בין שרשרת הנשימה ל-ATP synthase), טבלה בעמוד מספר 739 (פירוט חומרים מעכבים).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר האלקטרונים+ סינתזת ATP.
להרחבה- Lehninger, מהדורה שמינית, פרק 19, עמודים 2408-2410 (חקר הצימוד בין שרשרת הנשימה ל-ATP synthase), טבלה בעמוד מספר 2382 (פירוט חומרים מעכבים).
ביוכימיה 5 שאלה 19
מה מהבאים יתרחש אם העברת האלקטרונים במיטוכונדריה תיחסם ע”י אנטימיצין antimycin A) A) במעבר בין ציטוכרום b וציטרוכרום c1?
במה השאלה עוסקת: זירחון חימצוני- oxidative phosphorylation.
תשובה א. לקומפלקסים המרכיבים את שרשרת מעבר האלקטרונים ול-ATP synthase, יש חומרים שונים המעכבים אותם. בזכות שימוש בחומרים אלו מדענים חקרו את הצימוד בין חימצון בשרשרת מעבר האלקטרונים לזירחון בעת ייצור ATP. אנטימיצין A (antimycinA) היא אנטיביוטיקה שגורמת לחסימה של מעבר האלקטרונים בין cytochrome b (cyt) ל- cyt c1 שהן קבוצות פרוסטטיות בקומפלקס III. חסימהשל מעבר האלקטרונים בקומפלקס III מפסיקהאת שרשרת מעבר האלקטרונים, פרוטונים לא מועברים מהמטריקס למרווח הבין ממברנלי וייצור ה-ATP פוסק כי אין כוח מניע שיגרום ליצירתו (הכוח נובע מהפרש הריכוזים והמטענים של הפרוטונים בין צידי הממברנה הפנימית).
שלילת מסיחים:
ב. יחס P/O הוא היחס בין כמות החמצן הנצרך לכמות ה-ATP המסונתז בתהליך הזירחון החימצוני בלבד (תוך החסרת הכמויות בתהליכים האחרים בהם חמצן נצרךאו ATP מסונתז). כאשר NADH משמש כתורם אלקטרונים היחס הוא 2, וכאשר succinate הוא תורם האלקטרונים היחס הוא1. יחס P/O של 1 אומר שעל כל 1/2O2 שנצרך, נוצרת מולקולה אחת של ATP. ידוע לנו, על פי הפירוט לעיל, שהייצור של ATP בעקבות אנטימיצין A פוסק וצריכת החמצן יורדת. אך גם אם הייצור של ATP היה ממשיך, אז היינו מצפים שהיחס P/O רק יעלה ולא ירד ל-1.
ג. צריכת חמצן בתהליך הזירחון החימצוני היא ביחס ישר להעברת האלקטרונים מ-NADH מכיוון שחמצן נצרך על מנת שיהיה מקבל האלקטרונים האחרון בשרשרת מעבר האלקטרונים. ללא חימצון של NADH בקומפלקס I בשרשרת מעבר האלקטרונים, לא יהיו אלקטרונים להעביר לחמצן והוא לא ייקשר לקומפלקס IV. בשימוש באנטימיצין A יש עצירה של שרשרת מעבר האלקטרונים בזכות חסימה של מעבר האלקטרונים בקומפלקס III. מכאן שכל הקומפלקסים לפני קומפלקס זה מחוזרים ואין עוד אלקטרונים שנתרמים מ-NADH או כל תורם אלקטרונים אחר. מכיוון שאין מעבר של אלקטרונים בקומפלקס III, קומפלקס IV חסר אלקטרונים להעביר לחמצן ולכן גם חמצן לא נצרך במצב זה.
ד. ציטוכרומים (cytochrome, cyt) הם חלבונים בעלי בליעה חזקה של אור בזכות הקבוצה הפרוסטטית שלהם- קבוצת ה-heme בעלת אטום הברזל. ישנם 3 סוגים של ציטוכרומים במיטוכונדריה- a, b,c ששונים בספקטרום האור שהם בולעים. חלבון אחד מתוך הציטוכרומים שנקרא ציטוכרום c הינו חלבון מסיס שעובר אינטראקציה אלקטרוסטטית עם הצד החיצוני של הממברנה הפנימית של המיטוכונדריה. ציטוכרונים לא מסיטים אנרגיה כלשהי שיכולה לשמש לייצור ATP.
להרחבה- Lehninger, מהדורה שישית, עמודים 735-743 (נשאי אלקטרונים והקומפלקסיםשל שרשרת הנשימה), 755-757 (יחס P/O).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר האלקטרונים+ סינתזת ATP.
להרחבה- Lehninger, מהדורה שמינית, פרק 19, עמודים 2372-2394 (נשאי אלקטרונים והקומפלקסים של שרשרת הנשימה), 2434-2435 (יחס P/O).
ביוכימיה 5 שאלה 20
במיטוכונדריה נורמלית, מה נכון בנוגע לקצב צריכת NADH (חמצון)?
במה השאלה עוסקת: זירחון חימצוני- oxidative phosphorylation.
תשובה ד. בזירחון חימצוני, שרשרת מעבר האלקטרונים ו-ATP synthase תלויים בפעילות אחד של השני. כאשר יש עצירה של פעילות שרשרת מעבר האלקטרונים (בגלל מעכבים כמו ציאניד- cyanide, שמעכב את קומפלקס IV או אנטימיצין A- antimycin A שמעכבר את קומפלקס III), אין מעבר של פרוטונים מהמטריקס למרווח הבין ממברנלי, לא נוצר גרדיינט פרוטונים ולכן אין כוח מניע שגורם למעבר פרוטונים חזרה למטריקס וליצירת ATP ב-ATP synthase. כאשר יש עצירה של פעילות ATP synthase (בגלל מעכבים כמו אוליגומיצין- Oligomycin) אז אין מעבר של פרוטונים חזרה מהמרווח הבין ממברנלי למטריקס. ההוצאה של פרוטונים למרווח הבין ממברנלי ממשיכה בזכות שרשרת מעבר האלקטרונים ונוצר גרדיינט גדול מאוד בין צידי הממברנה הפנימית של המיטוכונדריה. כתוצאה מכך נדרשת יותר ויותר אנרגיה על מנת להמשיך להוציא פרוטונים בכיוון הגרדיינט עד שלבסוף האנרגיה הנדרשת גבוה מידי ומעבר האלקטרונים מ-NADH לחמצן לא מספיק אקסרגוני (exergonic, ΔG<0) לשם כך. במצב זה, מעבר האלקטרונים שדרך שרשרת הנשימה נפסק. NADH שנוצר בתהליכים קטבוליים רבים הוא תורם אלקטרונים חשוב לשרשרת הנשימה. כאשר שרשרת הנשימה נעצרת, כך גם הצריכה של NADH על ידי הנפסקת.
אם ATP synthase מעוכב, על פי האמור לעיל גם שרשרת הנשימה נעצרת והצריכה של NADH יורדת. מפרי צימוד כמו 2,4- dinitrohenol (DNP) או carbonylcynide-p-trifluoromethoxy-phenylhydrazone (FCCP) הם חומצות חלשות עם תכונות הידרופוביות שמאפשרות להם לנוע במברנה. הם נקשרים לפרוטון במרווח הבין ממברנלי, משחררים אותו במטריקס וכך מפרים את גרדיינט הפרוטונים. מפרי צימוד נוספים הם יונופורים (ionophores) כמו valinomycin שמאפשרים ליונים אנאורגניים לעבור את הממברנה וכך מפרים את הבדל המטענים בין צידי הממברנה. שני סוגי מפרי הצימוד גורמים לכך ששרשרת הנשימה תמשיך לעבוד (האנרגיה הנדרשת להוצאת פרוטונים קטנה מספיק) גם כאשר ATP synthase מעוכב ולכן גם צריכת NADH עולה בהתאם. לכן מסיח א נכון.
ADP הוא סובסטרט של ATP synthase ליצירת ATP. כאשר כמות ה-ADP במיטוכונדריה יורדת יש עיכוב של הפעילות של ATP synthase. כתוצאה מכך, גם עילות שרשרת הנשימה יורדת וצריכת NADH יורדת בהתאם. לכן מסיח ב נכון.
ציאניד הוא חומר שחוסם את פעילות קומפלקס IV וכך מפסיק את פעילותה של שרשרת מעבר האלקטרונים. בעקבות כך צריכת NADH יורדת ולכן מסיח ג נכון.
להרחבה- Lehninger, מהדורה שישית, עמודים 748-749 (צימוד בין שרשרת הנשימה לייצור ATP).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר האלקטרונים+ סינתזת ATP+ ניצול NADH ציטוזולי.
להרחבה- Lehninger, מהדורה שמינית, פרק 19, עמודים 2408-2413 (צימוד בין שרשרת הנשימה לייצור ATP), טבלה 19-4 בעמוד 2382 (פירוט חומרים מעכבים).
ביוכימיה 5 שאלה 21
מה יהיו ההשלכות של על המטבוליזם בשינוי חומצות האמינו סרין (SER) הנמצאת באתר הפעיל של האנזים acetyl-CoA carboxylase לחומצת אמינו אספרטט?
במה השאלה עוסקת: סינתזה של חומצות שומן- lipid biosynthesis.
תשובה א. ליפידים הם הצורה העיקרית שבה אנרגיה נאגרת בגופם של רוב האורגניזמים.ליפידים נאגרים בצורת טריגליצרידים (triglycerides) המורכבים מחומצות שומן וגליצרול. ייצור חומצות שומן מערב מולקולה בעלת 3 פחמנים שנקראת Malonyl-CoA. Acetyl-CoA carboxylase הוא האנזים היוצר Malonyl-CoA בעזרת הוספת קבוצת קרבוקסיל מביקרבונט (Bicarbonate, HCO3-) ל-Acetyl-CoA בתהליך בלתי הפיך (מאוד אקסרגוני, ΔG<0). האנזים מכיל קבוצה פרוסטטית של ביוטין (biotin) שחשובה לפעילות הקרבוקסילציה (carboxylation, הוספת קרבוקסיל) שלו.מולקולת הביוטין קשורה קוולנטית לקבוצה האמינית על פחמן e (e-amino group, קבוצה אמינית שקשורה לפחמן האחרון בשרשרת) בחומצה האמינית ליזין (Lysin).
כדאי לזכור בהקשר זה את התפקיד של ביוטין כקבוצה פרוסטטית בריאקציות נוספות של קרבוקסילציה כמו Pyruvate carboxylase שמוסיף קרבוקסיל ל-Pyruvate ליצירת Oxaloacetate, או Propionyl-CoAcarboxylase שמשתתף בריאקציות האחרונות של חימצון בטא לחומצות שומן אי-זוגיות.
רמת Malonyl CoA עולה כאשר הגוף רווי באנרגיה, מאגרי הגליקוגן מלאים ועודפי גלוקוז מומרים לחומצות שומן לאחסון כטריגליצרידים. כאשר יש עודף אנרגיה בגוף, יש צורך לעצור תהליכים שמייצרים אנרגיה זמינה כמו חימצון בטא (תהליך פירוק של חומצות שומן ליצירת אנרגיה זמינה). Malonyl CoA שמסמן עודף אנרגיה בגוף, מעכב אלוסטרית את Carnitine acyl transferase I, אנזים המשתתף בחימצון בטא וחשוב להתחייבות של חומצות שומן כלפי מסלול זה במיטוכונדריה. עיכוב של אנזים זה מעכב את כל המסלול של פירוק חומצות שומן בחימצון בטא.
כדאי לזכור בהקשר זה ש- Carnitineacyl transferase I הוא אנזים המזרז את הריאקציה השנייה ב- carnitine shuttle. שאטל זה מעביר חומצות שומן בעלות 14 פחמנים ומעלה את הממברנה של המיטוכונדריה (חומצות שומן עם 12 פחמנים ומטה יכולות לעבור את הממברנה של המיטוכונדריה בדיפוזיה פשוטה).בריאקציה הראשונה של השאטל חומצת שומן מצומדת ל-CoA ליצירת fatty acyl-CoA, תוך שימוש בATP. בריאקציה השנייה של השאטל מתרחשת טרנס-אסטריפיקציה של קרניטין ל-fatty acyl-CoA ליצירת fatty acyl-carnitine. בריאקציה השלישית התוצר מועבר בדיפוזיה דרך טרנספורטר למטריקס של המיטוכונדריה. תהליך הכניסה של חומצות שומן למיטוכונדריה דרך shuttle זה, הוא שלב קובע מהירות בחימצון של חומצות שומן ומהווה נקודת בקרה חשובה.
סרין (Serine) היא חומצה אמינית פולרית בעלת השייר CH3-OH ואספרטט (Aspartate) היא חומצה אמינית טעונה שלילית בעלת השייר CH3-COO-. בזכות השוני בין השתיים, ניתן להגיד שכאשר משנים את החומצה האמינית סרין באתר הפעיל של האנזים Acetyl-CoA carboxylase לאספרטט, מורידים את פעילותו. במצב זה רמות Malonyl-CoA ירדו והבקרה שמולקולה זו מבצעת על תהליך חימצון בטא תהיה נמוכה יותר. כתוצאה מכך תהליך חימצון בטא יגבר.
שלילת מסיחים:
ב. חומצות שומן ותוצרי ביניים של מסלול הסינתזה של חומצות שומן לא מבקרים את הסינתזה של גלוקוז. לכן במצב של ירידה בפעילות Acetyl-CoA carboxylase ובמסלול הסינתזה של חומצות שומן, לא תהיה השפעה על מסלול הגלוקונאוגנזה (gluconeogenesis)- מסלול הסינתזה של גלוקוז.
כדא ילזכור בהקשר זה שחומצות שומן ארוכות משתתפות בבקרה על Pyruvate kinase (האנזים האחרון בגליקוליזה) וכך מעכבות את היצירה של פירובט שמתפרק לאחר מכן ל-Acetyl CoA (אבן הבניין ליצירת חומצות שומן). בקרה זו טובה למצב בו יש עודף של חומצות שומן ועודף אנרגיה בגוף.
ג. חומצות שומן מעכבות את הפעילות של Pyruvate dehydrogenase complex (PDH) שיוצר Acetyl-CoA מפירובט ותוצר זה ממשיך לפירוק במעגל קרבס. אם יש עיכוב בפעילות האנזים Acetyl-CoAcarboxylase ויש ירידה בסינתזה של חומצות שומן אז הפעילות של PDH לא מעוכבת. כתוצאה מכך הפעילות של מעגל קרבס לא מושפעת או אף עולה.
ד. פגיעה באנזים Acetyl-CoA carboxylase פוגעת במסלול הסינתזה של חומצות שומן כפי שהוסבר קודם לכן.
להרחבה- Lehninger, מהדורה שישית, עמודים 79 (מבנה של חומצות אמינו), 607 (בקרה על גליקוליזה) 649 (pyruvate carboxylase), 654 (בקרה על מעגלקרבס), 671-672 (carnitine shuttle), 678 (חימצון בטא לחומצות שומן אי-זוגיות), 833-834 (סינתזה של Malonyl CoA), 679 (בקרה על חימצון בטא).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן.
להרחבה- Lehninger, מהדורה שמינית, פרק 3,14,17, 16 עמודים 367 (מבנה של חומצות אמינו), 1978 (בקרה על גליקוליזה) (pyruvate carboxylase), 2144(בקרה על מעגל קרבס), 2191-2192 (carnitine shuttle), 2229-2230,
2217- 2219 (חימצון בטא לחומצות שומן אי-זוגיות), 2648-2650 (סינתזה של Malonyl CoA), 2228(בקרה על חימצון בטא).
ביוכימיה 5 שאלה 22
צום של 24 שעות בשילוב עם מחסור באנזים carnitine acyl transferase I יתבטא ברמות נמוכות בדם של אילו מהמלקולות הכתובות מטה?
במה השאלה עוסקת: חימצון בטא- β oxidation.
תשובה ב. מאגרי האנרגיה באדם בוגר ובריא הם- גליקוגן בכבד ובשרירים, טריגליצרידים (triglycerides) ברקמת שומן וחלבונים מהרקמות. כל אלה יכולים לשמש ליצירת אנרגיה בעת הצורך. רמות גלוקוז בדם יורדות מעט כשעתיים לאחר ארוחה והרקמות מקבלות גלוקוז שמשוחרר מגליקוגן בכבד. ייצור של טריגליצרידים נעצר בזמן זה. כארבע שעות לאחר ארוחה רמות הגלוקוז בדם יורדות עוד קצת, הפרשת אינסולין (Insulin, הורמון שגורם לספיגה מוגברת של גלוקוז ברקמות ולגליקוליזה) יורדת והפרשת גלוקגון (Glucagon, הורמון שגורם להגברת יצירת גלוקוז בכבד והפרשתו) עולה. מצב הורמונלי זה גורם לפירוק טריגליצרידים ברקמת שומן, הפרשת חומצות שומן (free fattyacids) לדם ושימוש שלהן כמקור עיקרי לאנרגיה ברקמות. בצום ארוך של 24 שעות יש צורך לספק מספיק גלוקוז למוח (רקמה זו לא יכולה לנצל חומצות שומן כאנרגיה). לכן הכבד מפרק חלבונים מסוימים שאינם חיוניים ומייצר מהשלד הפחממני של חומצות אמינו גלוקוגניות (glucogenic aminoacids, חומצות שומן שיכולות להיכנס למסלול הגלוקוניאוגנזה) גלוקוז. חומרים המשתתפים במעגל קרבס מנותבים גם כן ליצירת גלוקוז בכבד. חומצות שומן מפורקות בחימצון בטא ל-Acetyl-CoA שאמור להיכנס למעגל קרבס, אך דבר זה לא קורה כי יש חוסר במגיבים של מעגל קרבס בכבד שנותבו ליצירת גלוקוז. הצטברות Acetyl-CoA מגבירה את מסלול הקטוגנזה (ketogenesis, ייצור גופי קטון), ייצור של Acetoacetyl-CoA מ-2 מולקולות של Acetyl-CoA ומשם ייצור גופי קטון. כך רמות גופי הקטון עולות בדם ומשמשות כמקור אנרגיה ללב, שרירים ומוח.
גופי הקטון הם acetone, acetoacetate ו- D-b-hydroxybutyrate, כאשר אצטון נוצר בכמויות קטנות יחסית ומופרש בריאות. שני גופי הקטון האחרים נספגים ברקמות (מלבד הכבד),מומרים חזרה ל- Acetyl CoA ותוצר זה נכנס למעגל קרבס. בכבד חסר האנזים במסלול שממיר את גופי הקטון חזרה ל-Acetyl CoA, לכן הוא רק יוצר גופי קטון ולא משתמש בהם בעצמו. יצירת גופי קטון מאפשרת את המשך הניצול של חומצות שומן כאנרגיה בחימצון בטא כאשר אין יכולת ל-Acetyl-CoA להיכנס למעגל קרבס בכבד.
כדאי לזכור בהקשר זה שתהליך גלוקוניאוגנזה (gluconeogenesis, יצירת גלוקוז) מתרחש בעיקר בכבד (מעט בכליות). כתוצאה מכך, ייצור גלוקוז ממגיבים של מעגל קרבס מתרחש בכבד בלבד ורק בו לא מתבצע מעגל קרבס במצב של חוסר בגלוקוז. לכן פירוק של Acetyl-CoA במעגל קרבס בצום ממושך, מתאפשר ברקמות אחרות בגוף אך לא בכבד.
Carnitine acyl transferase I הוא אנזים המזרז את הריאקציה השנייה ב- carnitineshuttle. שאטל זה מעביר חומצות שומן בעלות 14 פחמנים ומעלה את הממברנה של המיטוכונדריה (חומצות שומן עם 12 פחמנים ומטה יכולות לעבור את הממברנה של המיטוכונדריה בדיפוזיה פשוטה). בריאקציה הראשונה של השאטל חומצת שומן מצומדת ל-CoA ליצירת fattyacyl-CoA, תוך שימוש בATP. בריאקציה השנייה של השאטל מתרחשת טרנס-אסטריפיקציה של קרניטין ל-fatty acyl CoA ליצירת fattyacyl-carnitine. בריאקציה השלישית התוצר מועבר בדיפוזיה דרך טרנספורטר למטריקס של המיטוכונדריה. תהליך הכניסה של חומצות שומן למיטוכונדריה דרך shuttle זה, הוא שלב קובע מהירות בחימצון של חומצות שומן ומהווה נקודת בקרה חשובה.
מחסור באנזים Carnitineacyl transferase I מונע כניסה של חומצות שומן למיטוכונדריה ואת הפירוק שלהן בחימצון בטא. במצב כזה אין ייצור של Acetyl-CoA במיטוכונדריה מחומצות השומן.לכן Acetyl-CoA לא מצטבר בצום של 24 שעות ולא דוחף את הגברת המסלול של קטוגנזה. לכן במצב כזה, רמות גופי הקטון בדם יהיו נמוכות.
שלילת מסיחים:
א. במצב של צום תהליכי ניוד טריגליצרידים לרקמות והפירוק שלהם לחומצות שומן מוגברים כדי לספק אנרגיה זמינה לרקמות. מחסור באנזים Carnitineacyl transferase I לא משפיע על ניוד שלטריגליצרידים בדם או על הירוק שלהם לחומצות שומן, אלא על הפירוק של חומצות שומן אלה בחימצון בטא. לכן לא תהיה ירידה ברמות הטריגליצרידים בדם במצב זה.
ג. הירידה העיקרית של רמות הגלוקוז בדם בזמן צום קורת בשעות הראשונות. במצב תקין רמות הגלוקוז בדם לא יורדות בצורה משמעותית בין 4 ל-24 שעות של צום.
מחסור באנזים Carnitine acyl transferase I לאמשפיע על רמות הגלוקוז המשוחררות לדם אלה על תהליך חימצון בטא ורמות ה-Acetyl-CoA שנוצרות בתא.
ד. רמות גלוקוז לא מושפעות מחוסר באנזים Carnitineacyl transferase I ולכן סעיף זה לא נכון.
להרחבה- Lehninger, מהדורה שישית, עמודים 671-672 (carnitine shuttle), 686 (גופי קטון) 956-958 (תגובת הגוף לצום).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן+ גופי קטון.
להרחבה- Lehninger, מהדורה שמינית, פרק 17, עמודים 2191-2195 (carnitine shuttle), 2240, פרק 23- (גופי קטון 3019-3023 (תגובת הגוף לצום)
ביוכימיה 5 שאלה 23
באיזה מבין המצבים הבאים נצפה לסינתזה מוגברת של גופי קטון?
במה השאלה עוסקת: גופי קטון- Ketone bodies.
תשובה ד. Acetyl CoA שנוצר בחימצון בטא (פירוק חומצות שומן ליצירת אנרגיה) או מפירובט (Pyruvate) בעזרת האנזים PDH (Pyruvate dehydrogenase complex), יכול להיכנס למעגל קרבס ולהתפרק ל-CO2 ליצירת אנרגיה זמינה בצורת נשאי אלקטרונים ו-ATP. מסלול אלטרנטיבי שמתרחש בכבד הוא קטוגנזה (Ketogenesis) בו 2 מולקולות של Acetyl-CoA יוצרות גופי קטון. גופי הקטון הם acetone, acetoacetate ו- D-b-hydroxybutyrate, כאשר אצטון נוצר בכמויות קטנות יחסית ומופרש בריאות. שני גופי הקטון האחרים נספגים ברקמות (מלבד הכבד), מומרים חזרה ל- AcetylCoA ותוצר זה נכנס למעגל קרבס. בכבד חסר האנזים במסלול שממיר את גופי הקטון חזרה ל-Acetyl CoA, לכן הוא רק יוצר גופי קטון ולא משתמש בהם בעצמו. יצירת גופי קטון מאפשרת את המשך הניצול של חומצות שומן כאנרגיה בחימצון בטא כאשר אין יכולת ל-Acetyl-CoA להיכנס למעגל קרבס בכבד. מצבזה קורה כאשר המגיבים של מעגל קרבס בכבד מנותבים ליצירת גלוקוז בתהליך הגלוקוניאוגנזה (gluconeogenesis) ואין מספיק מהם להתרחשות של מעגל קרבס.
שני מצבים רפואיים גורמים לסינתזה מוגברת של גופי קטון- רעב וסוכרת. ברעב תהליך הגלוקוניאוגנזה בכבד מוגבר ליצירת גלוקוז שיספק רקמות המסתמכות בעיקר עליו לאנרגיה (מוח). המגיבים של מעגל קרבס מנותבים לגלוקוניאוגנזה ורמתם יורדת למצב שלא מאפשר התרחשות של מעגל קרבס. בנוסף לכך, מוגבר תהליך הפירוק של חומצות שומן ל- Acetyl-CoA (חימצון בטא). תוצר זה מצטבר מכיוון שאינו מנוצל למעגל קרבס והצטברותו מגבירה את מסלול הקטוגנזה. סוכרת לא מטופלת מדמה מצב של רעב ברקמות, מכיוון שכאשר רמות האינסולין בדם לא מספיקות, הרקמות בגוף לא יכולות לספוג גלוקוז בצורה אפקטיבית. תהליך חימצון בטא מוגבר כדיל ספק אנרגיה במקום גליקוליזה (glycolysis), Acetyl CoA מצטבר, אינו נכנס למעגל קרבס בגלל שימוש של המגיבים לגלוקוניאוגנזה וכך מוגבר מסלול הקטוגנזה.
כאשר רמות Oxaloacetate במיטוכונדריה נמוכות אז אין מספיק ממנו שיגיב עם Acetyl-CoA בריאקציה הראשונה של מעגל קרבס. במצב כזה Acetyl-CoA מצטבר בתא ולבסוף מנותב לייצור גופי קטון. כך מסלול הסינתזה שלגוי קטון מוגבר.
שלילת מסיחים:
א. יחס אינסולין/גלוקגון גבוה אומר שיש ריכוז גבוה של אינסולין בדם וריכוז נמוך של גלוקגון. אינסולין גבוה בדם כאשר רמות הגלוקוז בדם גבוהות. אם מדובר באדם שאינו סוכרתי הגלוקוז נספג ברקמות בעקבות אינסולין. במצב זה אין צורך בייצור גופיקטון שיחליפו את הגלוקוז באספקת אנרגיה לרקמות.
ב. Citrate הוא תוצר של הריאקציה הראשונה במעגל קרבס (Citrate synthase מחבר ל-Oxaloacetate 2 פחמנים מ- Acetyl-CoA ומשחרר (CoA. הצטברותו מסמנת רוויה ממסלולים מספקי אנרגיה כמו גליקוליזה, חימצון בטא וקטבוליזם של חומצות אמינו. במצב זה יש עודף של מולקולות מספקות אנרגיה כמו גלוקוז, חומצות שומן וכו’ ואין צורך בייצור מוגבר של גופי קטון שנוצרים במחסור של גלוקוז.
ג. Fructose 2.6-bisphosphate (F2,6P) היא מולקולה המבקרת את המעבר מגליקוליזה לגלוקוניאוגנזה ומשמשת כבקר אלוסטרי (allosteric effector) לאנזימים Phosphofructokinase-1 (PFK-1) ו- Fructose 1,6-bishoshatase (FBPase-1). PFK-1 הוא אנזים שמזרז את הריאקציה השלישית בגליקוליזה ומזרחן את Fructose 6-phosphate על פחמן 1 ל- Fructose 1,6-bisphosphate. FBPase-1 הואאנזים המשתתף בגלוקוניאוגנזה המבצע הידרוליזה ל- Fructose1,6-bisphosphate ומסיר ממנו זרחן לקבלת Fructose 1,6-bisphosphate. F2,6P מגביר את האפיניות של PFK-1 לסובסטרט שלו ומוריד את האפיניות שלו למעכבים האלוסטרים שלו ATP) ו-Citrate), כך הוא מגביר את תהליך הגליקוליזה. בניגוד לכך, F2,6P מוריד את האפיניות של FBPase-1 לסובסטרט שלו וכך הוא מאט את תהליך הגלוקוניאוגנזה. ריכוז F2,6P תלוי בקצב היצירה והפירוק שלו. Phosphofructokinase-2 (PFK-2) יוצר F2,6P על ידיזירחון של Fructose 6-phosphate בפחמן2. הסרת הזרחן מפחמן 2 נעשית ע”י Fructose2,6-bishoshatase (FBPase-2). שני אנזימים אלה הם תתי יחידות של אנזים אחד ביפונקציונאלי (bifunctional protein, בעל שתי פונקציות) שפעולותיו מבוקרות ע”י ההורמונים גלוקגון ואינסולין. גלוקגון מפעיל PKA (Protein Kinase A) שמזרחן את האנזים הביפונקציונאלי וזירחון זה גורם להפעלה של פעילות FBPase-2. כך רמת F2,6P יורדת ופעילותו גלוקוניאוגנזה עולה (דבר התואם את פעילות גלוקגון כמעודד ייצור של גלוקוז כאשר ריכוזו בדם יורד). אינסולין מפעיל Phosphoprotein phosphatase שמסיר את הזירחון מהאנזים הביפונקציונאלי וכך גורם להפעלה של פעילות PFK-2. כך רמת F2,6P עולה ופעילותו גליקוליזה עולה (דבר התואם את פעילות אינסולין כמעודד פירוק של גלוקוז כאשר ריכוזו בדם עולה).
כדאי לזכור בהקשר זה:
1. קסקדת הסיגנלים המופעלת בעקבות קישור גלוקגון או אפינפרין ל-G protein coupled receptor (GPCR) עם תת יחידה אלפא מסוג Gs. הרצפטור משנה קונפורמציה, מתפקד כ-GEF (guanine nucleotide exchange factor) וגורם לניתוק GDP מתת יחידה אלפא בחלבון G ולקישור GTP. חלבון G משנה קונפורמציה וכך תת יחידה אלפא מתנתקת מתתי יחידות בטא וגמא ומפעילה את האנזים Adenylyl cyclase שיוצר cAMP מ-ATP. 4 מולקולות של cAMP נקשרות לשתי היחידות הרגולטוריות של PKA ומנתקות אותן כך ש-PKA מופעל ומזרחן חלבונים במורד הזרם.
2. קסקדת הסיגנלים המופעלת בעקבות קישור של אינסולין ל- ReceptorTyrosine Kinase (RTK). קישור של אינסולין גורם לדימריזציה (dimerization) של שתי תתי יחידות של הרצפטור שמפעילה פעילות של tyrosine kinase בכל תת יחידה כך שהן מזרחנות אחת את השנייה ב- tyrosines ספציפיים בתהליך שנקרא trans-autophosphorylation. הזירחונים יוצרים נקודות קישור אליהן נקשרים חלבונין. אחד המסלולים העיקריים שמופעלים בעקבות קישור אינסולין הוא PI-3-kinase-Akt. במסלולזה Phosphoinositide 3-kinase (PI 3-kinase) נקשר ובעקבות כך מזרחן את הפוספוליפיד (phospholipid) inositol בממברנה ל- phosphatidylinositoltriphosphate (PIP3). PIP3 מגייס שני קינאזות לממברנה- AKT שנקרא גם PKB (Protein kinase B) ו- phosphoinositide-dependent protein kinase 1 (PDK1). כך AKT מופעל ומזרחן חלבונים במורד הזרם.
רמות F2,6P גבוהות אם כך, נובעות מהפעלה של אינסולין.אינסולין מופרש כאשר יש רמות גבוהות של גלוקוז בדם. במצב זה אין צורך בייצור מוגבר של גופי קטון, שתפקידם להחליף את גלוקוז כמקור אנרגיה כאשר ריכוזו נמוך בדם.
להרחבה- Lehninger, מהדורה שישית, עמודים 604 (Citrateכמולקולת בקרה), 605-606 (בקרה על גלוקוניאוגנזה וגליקוליזה), 638-647 (מעגלקרבס), 686-688 (גופי קטון). Alberts, מהדורה שישית, עמודים 832-833 (GPCR ויצירת cAMP), 860 (PI-3-kinase-Akt).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן+ גופי קטון.
להרחבה- Lehninger, מהדורה שמינית, פרק 14, עמודים 1970 (Citrateכמולקולת בקרה), 1971-1974 (בקרה על גלוקוניאוגנזה וגליקוליזה), פרק 16, 2102-2128 (מעגל קרבס), פרק 17, 2240-2247 (גופי קטון). Alberts, מהדורה שביעית, פרק 15, עמודים 892-894 (GPCR ויצירת cAMP), (PI-3-kinase-Akt) 921.
ביוכימיה 5 שאלה 24
מהם תוצרי חמצון בטא של חומצת שומן עם 18 פחמנים ושני קשרים כפולים בפחמן 12 ובפחמן 15?
במה השאלה עוסקת: חימצון בטא- β oxidation.
תשובה א. חימצון בטא הוא תהליך בו חומצות שומן מומרות ל-Acetyl CoA, מולקולה בעלת 2 פחמנים שבהמשך מפורקת במעגל קרבס ל-CO2. תהליך זה מאפשר ניצול של חומצות שומן ליצירת אנרגיה זמינה ומהווה חלק מרכזי מתהליכי יצירת האנרגיה ברקמות מסוימות בגוף (מספק 80% מהדרישות האנרגטיות של הלב והכבד).בבעלי חיים, חימצון בטא מתרחש במטריקס של המיטוכונדריה ע”י 4 אנזימים. סבב אחד של התהליך הכולל- חימצון, הידרציה, חימצון ותיוליזה (Thiolysis), מניב מולקולה אחת של acetyl-CoA,fatty acyl-CoA שקצרה ב-2 פחמנים, FADH2, NADH + H+.
חומצות שומ בלתי רוויות שנצרכות מהטבע הן בקונפיגורציה cis. בתהליך חימצון בטא של חומצת שומן רוויה, התוצר של הריאקציה הראשונה הוא בקונפיגורציה trans והאנזים הפועל עליו בריאקציה השנייה (enoyl-CoA hydratase) לא יכול לעבוד על חומצות שומן בקונפיגורציה cis. יש צורך בשני אנזימים נוספים- איזומראז (isomerase) ורדוקטאז (reductase). חומצות שומן עם קשר אחד כפול דורשות את האיזומראז על מנת להמיר את הקשר הכפול ל-trans, ולאחר מכן התוצר מדלג על הריאקציה הראשונה של חימצון בטא ועובר לריאקציה השנייה. בצורה זו אין יצירה של FADH2 באחד הסבבים בחימצון בטא של חומצת שומן עם קשר כפול אחד.
חומצות שומן עם שני קשרים כפולים דורשות את האיזומראז וגם את הרדוקטאז. רדוקטאז דורש NADPH לפעילותו. שילוב הפעולה של שניהם מאפשרת המשך של חומצת השומן בחימצון בטא. חומצת שומן עם שני קשרים כפולים לא מייצרת FADH2 בסבב אחד ובנוסף דורשת NADPH בסבב אחר.
לכן חומצת שומן של 18 פחמנים בעלת 2 קשרים כפולים תעבור 8 סבבים של חימצון בטא ותתפרק ל-9 מולקולות של acetyl-CoA, 7 FADH2, 8 NADH +H+ ו- NADP+ אחד.
להרחבה- Lehninger,מהדורה שישית, עמודים 673-675 (חימצון בטא), 677 (חימצון בטאלחומצות שומן בלתי רוויות).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן.
להרחבה- Lehninger, מהדורה שמינית, פרק 17, עמודים 2198-2207 (חימצון בטא), 2212-2216 (חימצון בטא לחומצות שומן בלתי רוויות).
ביוכימיה 5 שאלה 25
למטופל כלשהו יש יחס נמוך של אינסולין/גלוקגון בדם. כאשר מוסיפים את החומר ניטרופרוסיד לדגימת דם או שתן הוא מזהה מולקולות בעלות קבוצת קטון. איזה מבין המולקולות הבאות יזוהו בדגימת דם של המטופל המתואר?
במה השאלה עוסקת: גופי קטון- Ketone bodies.
תשובה ג. Acetyl CoA שנוצר בחימצון בטא (פירוק חומצות שומן ליצירת אנרגיה) או מפירובט (Pyruvate) בעזרת האנזים PDH (Pyruvate dehydrogenase complex), יכול להיכנס למעגל קרבס ולהתפרק ל-CO2 ליצירת אנרגיה זמינה בצורת נשאי אלקטרונים ו-ATP. מסלול אלטרנטיבי שמתרחש בכבד הוא קטוגנזה (Ketogenesis) בו 2 מולקולות של Acetyl-CoA יוצרות גופי קטון. גופי הקטון הם acetone, acetoacetate ו- D-b-hydroxybutyrate, כאשר אצטון נוצר בכמויות קטנות יחסית ומופרש בריאות. שני גופי הקטון האחרים נספגים ברקמות (מלבד הכבד), מומרים חזרה ל- Acetyl CoA ותוצר זה נכנס למעגל קרבס. בכבד חסר האנזים במסלול שממיר את גופי הקטון חזרה ל-Acetyl CoA, לכן הוא רק יוצר גופי קטון ולא משתמש בהם בעצמו. יצירת גופי קטון מאפשרת את המשך הניצול של חומצות שומן כאנרגיה בחימצון בטא כאשר אין יכולת ל-Acetyl-CoA להיכנס למעגל קרבס בכבד. מצב זה קורה כאשר המגיבים של מעגל קרבס בכבד מנותבים ליצירת גלוקוז בתהליך הגלוקוניאוגנזה (gluconeogenesis) ואין מספיק מהם להתרחשות של מעגל קרבס.
שני מצבים רפואיים גורמים לסינתזה מוגברת של גופי קטון- רעב וסוכרת. ברעב תהליך הגלוקוניאוגנזה בכבד מוגבר ליצירת גלוקוז שיספק רקמות המסתמכות בעיקר עליו לאנרגיה (מוח). המגיבים של מעגל קרבס מנותבים לגלוקוניאוגנזה ורמתם יורדת למצב שלא מאפשר התרחשות של מעגל קרבס. בנוסף לכך, מוגבר תהליך הפירוק של חומצות שומן ל- Acetyl-CoA (חימצון בטא). תוצר זה מצטבר מכיוון שאינו מנוצל למעגל קרבס והצטברותו מגבירה את מסלול הקטוגנזה. סוכרת לא מטופלת מדמה מצב של רעב ברקמות, מכיוון שכאשר רמות האינסולין בדם לא מספיקות, הרקמות בגוף לא יכולות לספוג גלוקוז בצורה אפקטיבית. תהליך חימצון בטא מוגבר כדי לספק אנרגיה במקום גליקוליזה (glycolysis), Acetyl CoA מצטבר,אינו נכנס למעגל קרבס בגלל שימוש של המגיבים לגלוקוניאוגנזה וכך מוגבר מסלול הקטוגנזה.
יחס נמוך של אינסולין/גלוקגון בדם אומר שיש רמות גבוהות של גלוקגון ביחס לאינסולין. מצב זה קורה ברעב כאשר הירידה ברמות הגלוקוז בדם מביאה לעליה בהפרשת הורמון הגלוקגון (glucagon, הורמון שגורם להגברת תהליך הגלוקוניאוגנזה) וירידה בהפרשת הורמון האינסולין (Insulin, הורמון שגורם להגברת הגליקוליזה). לכן יחס נמוך של אינסולין/גלוקגון הוא מצב בו נצפה לעליה בייצור של גופי קטון.
החומר ניטרופרוסיד (nitroprusside) מזהה קבוצות קטון. קטון הוא תרכובת אורגנית שמכילה קרבוניל (C=O) כאשר הפחמן מחובר לשתי שרשראות פחמניות (R1 ו- R2). שני גופי הקטון שמכילים קבוצה פונקציונאלית של קטון הם Acetone ו- Acetoacetate לכן ניטרופרוסיד יזהה מולקולות אלה בדם של מטופל בעל יחס נמוך של אינסולין לגלוקגון (שבדמו קיימים כל 3 גופי הקטון).
להרחבה- Lehninger, מהדורה שישית, 638-647 (מעגל קרבס), 686-688 (גופי קטון).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: גופי קטון.
להרחבה- Lehninger, מהדורה שמינית, פרק 16- 2102-2128 (מעגל קרבס), פרק 17- 2240-2247 (גופי קטון).
ביוכימיה 5 שאלה 26
המחלה propionic academia נגרמת בעקבות מחסור באנזים propionyl CoA carboxylase. במחלה, מצטברת חומצה פרופיונית בדם וגורמת לחמצת. איזה מבין הבאים נכון בנוגע למחלה זו?
במה השאלה עוסקת: חימצון חומצות שומן אי זוגיות.
תשובה ג. האנזים Propionyl-CoAcarboxylase משתתף בתהליכים האחרונים של פירוק חומצות שומן אי-זוגיות. הפירוק של חומצות שומן אי-זוגיות מתחיל בחמצון בטא, כבכל חומצות השומן הארוכות. הסובסטרט של הסבב האחרון של חומצות שומן אי-זוגיות בחמצון בטא הוא חומצת שומן בעלת 5 פחמנים שמפורקת ל- Acetyl-CoA ול- Propionyl-CoA בעלת 3 פחמנים. Acetyl-CoA נכנס למעגל קרבס ו-Propionyl-CoA מפורקת בתהליך ייחודי שצורך 3 אנזימים שהראשון שבהם הוא Propionyl-CoA carboxylase. האנזים מזרז קרבוקסילציה (carboxylation) של Propionyl-CoA ל- D-Methylmalonyl-CoA (D stereoisomer, זה הסטיראואיזומר הספציפי הנוצר בריאקציה זו).
חשוב לזכור ש-stereoisomers הם איזומרים (isomers) בעלי אותה נוסחה מולקולרית ואותם קשרים בין האטומים, אך שונים בסידור המרחבי שלהם. זאת בשונה מאיזומרים מבניים בעלי אותה נוסחה מולקולרית אךשונים בקשרים בין האטומים. מערכת D ו-L היאשיטה להבדיל בין סטיראואיזומרים של חומצות אמינו וסוכרים שמבוססת על הקונפיגורציה (configuration) של הסוכר glyceraldehyde. בטבע,סוכרים הם לרוב בקונפיגורציה D וחומצות אמינו הן בקונפיגורציה L.
התוצר עובר אפימריזציה (epimerization) לצורת הסטיראואיזומר L שלו ע”י האנזים Methylmalonyl-CoAepimerase. L-Methylmalonyl-CoA עובר ריאקציה של סידור קשרים תוך-מולקולריים בעזרת האנזים malonyl-CoA mutase. האנזים מנתק קבוצה פונקציונאלית שהייתה מחוברת לפחמן 2 ומעביר אותה לפחמן 3. התוצר של ריאקציה זו הוא Succinyl-CoA שנכנס לריאקציה החמישית במעגל קרבס.
לכן ללא האנזים Propionyl-CoA carboxylase לא יהיה ניתן ליצור Succinyl-CoA מחומצות שומן אי זוגיות.
שלילת מסיחים:
א. PLP (Pyridoxal phosphate) הוא קו-אנזים שמשתתף במטבוליזם של מולקולות עם קבוצת אמינו (בנוסף מצוי כקו-אנזים ב-Glycogen phosphorylase אך שם תפקודו לא מייצג את תפקודיו הרגילים כקו-אנזים). הוא מתפקד כנשא ביניים של קבוצות אמינו באתר הפעיל של האנזים Amino-transferase או Transaminase, אנזים המזרז את הריאקציה הראשונה בקטבוליזם של חומצות אמינו בכבד. האנזים Propionyl-CoA carboxylase מבצע ריאקציה של קרבוקסילציה שצורכת את הקו-אנזים Biotin. ביוטין מתפקד כנשא של CO2. CO2 מאוקטב כאשר הוא מחובר ל-biotin בריאקציה שדורשת ATP. האקטיבציה מאפשרת את העברתו לסובסטרט של האנזים, במקרה הזה- Propionyl CoA.
ב. האנזים Propionyl-CoA carboxylase לא משתמש ב-B12 כקו-אנזים אלא ב-biotin שמשמש לריאקציה של קרבוקסילציה כפי שהוסבר במסיח הקודם. האנזים האחרון בתהליך הפירוק של חומצות שומן אי-זוגיות הוא Methylmalonyl-CoA mutase. אנזים זה מזרז ריאקציה של סידור פנימי של קשרים בסובסטרט והוא נעזר לשם כך בקו-אנזים B12. B12 משתתף בריאקציות בהן קבוצת אלקיל (Alkyl) מפחמן אחד במולקולת הסובסטרט מוחלפת עם מימן מפחמן אחר ואין ערבוב של המימן המועבר עם מימן אחר מהממס H2O. ויטמין B12 ייחודי משאר הויטמינים במבנה האורגני המורכב שלו ובשימוש שלו ביסוד הקורט cobalt (trace element, חומרים שנצרכים בכמויות מאוד קטנות בגוף אך הכרחיים לתפקידם של חלבונים רבים). יסוד הקובלט (Co) קשור ב-4 קשרים לטבעת Corrin (בצבע כחול בתמונה) שדומה לטבעת Porphyrin שבקבוצות ה-heme (שמצויה בחלבונים רבים כמו חלבוני ציטוכרום והמוגלובין). קשר חמישי של קובלט הוא ל- dimethylbenzimidazole ribonucleotide (בצבע צהוב בתמונה) שקשור גם כן לטבעת ה-Corrin. הקשר השישי של קובלט בקו-אנזים B12 הוא לפחמן 5 של 5′-Deoxyadenosine (בצבע ורוד בתמונה). היכולת של B12 לקשור מימן בצורה שתאפשר את המעבר שלו לפחמן אחר באותה מולקולה ללא ערבוב עם מימנים בתמיסה מתאפשרת בזכות הקשר הקוולנטי החלש יחסית שנוצר בין קובלט לפחמן 5 של 5′-Deoxyadenosine. פירוק של הקשר הזה יוצר רדיקל של 5′-Deoxyadenosine שיכול לקשור את המימן מהסובסטרט וכך הסובסטרט הוא שהופך לרדיקל. בריאקציה של חומצות שומן אי-זוגיות האנזים Methylmalonyl-CoA mutase מעביר את קבוצת האלקיל לפחמן 3 וכך מתפנה מקום בפחמן 2 עבור המימן שקשור ל- 5′-Deoxyadenosine. 5′-Deoxyadenosine מתחבר חזרה לקובלט וכך מושלם מחזור של הריאקציה.
ד. Propionyl-CoA היא מולקולת הסובסטרט של האנזים Propionyl-CoA carboxylase והיא בעלת 3 פחמנים. לאחר קרבוקסילציה Propionyl-CoA הופכת ל- D-Methylmalonyl-CoA בעלת 4 פחמנים.
להרחבה- Lehninger, מהדורה שישית, עמודים 78 (מערכת סטיראואיזומרים D ו-L), 651 (biotin), 677-678 (חמצון חומצות שומן אי-זוגיות),680-681 (B12), 699 (PLP בקטבוליזם של חומצות אמינו).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן+ גופי קטון.
להרחבה- Lehninger, מהדורה שמינית, פרק 3, 16, 17, 18, עמודים 363-364 (מערכת סטיראואיזומרים D ו- L)
(biotin 2136-2137), 2212-2219(חמצון חומצות שומן אי-זוגיות),2220-2225 B12) בקטליזה של חומצות אמינו),
PLP 2272-2273.
ביוכימיה 5 שאלה 27
כל הבאים הם גורלות אפשריים של חומצה פלמיטית (C:16ׂ) שנכנסות לתא כבד, מלבד:
במה השאלה עוסקת: חומצות שומן.
תשובה ב. חומצה פלמיטית (palmiticacid, palmitate) היא חומצת שומן נפוצה בעלת 16 פחמנים. כאשר חומצת שומן זו נכנסת להפטוציט (hepatocyte, תא כבד) עומדים בפניה מספר גורלות אפשריים שהתרחשותם תלויה בצרכי התא. במצב של חוסר באנרגיה פלמיטט תכנס למיטוכונדריה ותתפרק בחימצון בטא (beta oxidation) ליצירת 8 מולקולות של Acetyl CoA. תוצר זה יכול להיכנס למעגל קרבס שתוצריו יכנסו לתהליך הזירחון החימצוני (oxidative phosphorylation) ליצירת אנרגיה זמינה בצורת ATP. במצב של מחסור בגלוקוז בגוף ייתכן ו-Acetyl CoA ינותב למסלול קטוגנזה (Ketogenesis) ליצירת גופי קטון שיופרשו מהכבד לשאר הרקמות, שם יהפכו חזרה ל-Acetyl CoA שיכנס למעגל קרבס. כאשר יש מחסור בכולסטרול בגוף ייתכן ו- Acetyl CoA ישמש לסינתזה שלו בציטוזול. אם יש צורך ביצירת פוספוליפידים (phospholipids), פלמיטט לא תיכנס למיטוכונדריה לחימצון בטא אלא תישאר בציטוזול, שם תתחבר לגליצרול ויחד עם עוד חומצות שומן וקבוצות פולריות היא תיצור פוספוליפידים.
חולייתנים לא יכולים להמיר חומצות שומן או Acetyl CoA לפחמימות (כמו גלוקוז). ההמרה של Phosphoenolpyruvate (PEP) ל-Pyruvate (ע”י האנזים Pyruvatekinase בגליקוליזה) ו-Pyruvate ל- Acetyl CoA (ע”י האנזים Pyruvate dehydrogenase complex, PDE) הם תהליכים אקסרגונים ((exergonic מאוד ונחשבים בלתי הפיכים. אם לא ניתן להמיר Acetyl CoA ל-PEP, Acetyl CoA לא יכול לשמש כחומר מוצא לתהליך הגלוקוניאוגנזה (Gluconeogenesis) ליצירת גלוקוז. באורגניזמים שונים מלבד חולייתנים, מנגנון ההמרה של Acetyl CoA לגלוקוז הוא דרך Glyoxylate cycle.
שלילת מסיחים:
א. Acetyl CoA שנוצר בחימצון בטא יכול להיכנס למעגל קרבס ולהתפרק ל-CO2 ליצירת אנרגיה זמינה בצורת נשאי אלקטרונים ו-ATP. מסלול אלטרנטיבי שמתרחש בכבד הוא קטוגנזה (Ketogenesis) בו 2 מולקולות של Acetyl-CoA יוצרות גופי קטון. גופי הקטון הם acetone, acetoacetate ו- D-b-hydroxybutyrate, כאשר אצטון נוצר בכמויות קטנות יחסית ומופרש בריאות. שני גופי הקטון האחרים נספגים ברקמות (מלבד הכבד), מומרים חזרה ל- Acetyl CoA ותוצר זה נכנס למעגל קרבס. בכבד חסר האנזים במסלול שממיר את גופי הקטון חזרה ל-Acetyl CoA, לכן הוא רק יוצר גופי קטון ולא משתמש בהם בעצמו. יצירת גופי קטון מאפשרת את המשך הניצול של חומצות שומן כאנרגיה בחימצון בטא כאשר אין יכולת ל-Acetyl-CoA להיכנס למעגל קרבס בכבד. מצב זה קורה כאשר המגיבים של מעגל קרבס בכבד מנותבים ליצירת גלוקוז בתהליך הגלוקוניאוגנזה (gluconeogenesis) ואין מספיק מהם להתרחשות של מעגל קרבס.
ג. כאשר יש צורך ביצירה של פוספוליפידים, חומצות שומן שנכנסות לתא לא נכנסות למיטוכונדריה אלא מתחברות לגליצרול או ספינגוזין (Sphongosine) כתלות בסוג הפוספוליפיד ומצורפת קבוצה הידרופילית. בתאים אאוקריוטים תהליך יצירת פוספוליפידים מתרחש ב-smooth endoplasmic reticulum ובממברנה הפנימית של המיטוכונדריה.
ד. כולסטרול משמש כמרכיב חשוב בממברנת התאים וכמולקולת מוצא להורמונים סטירואידים ומלחי מרה. מולקולת הכולסטרול היא מולקולה חיונית בבעלי חיים אך ביונקים אין צורך לצרוך אותה מהמזון מכיוון שניתן לייצר אותה בתוך התא מ- Acetyl CoA.
להרחבה- Lehninger, מהדורה שישית, עמודים 656-657 (חולייתנים ויצירת גלוקוז מחומצות שומן), 686 (גופיקטון), 852 (יצירת פוספוליפידים), 859 (יצירת כולסטרול).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן.
להרחבה- Lehninger, מהדורה שמינית, עמודים 2613-2616 (חולייתנים ויצירת גלקוז מחומצות שומן- פרק 20-לא בסילבוס אך חשוב לדעת), פרק 17- 2240-2241 (גופי קטון), פרק 21, 2713 (יצירת פוספוליפידים), 2733 (יצירת כולסטרול).
ביוכימיה 5 שאלה 28
בניסוי הדגירו מיטוכונדריה המכילות רק אנזימים וחלבונים המשתתפים בנשימה התאית. תחילה השרו את המיטוכונדריה בתמיסה בעלת pH 4 למשך מספר שעות. לאחר מכן השרו את המיטוכונדריה בתמיסה בעלת pH 7 ובדקו את פעילות האנזים ATP סינתאז (ATP Synthase). מה צפוי שיתרחש?
במה השאלה עוסקת: זירחון חימצוני- oxidative phosphorylation.
תשובה ג. זירחון חימצוני הוא תהליך יצירת ATP במיטוכונדריה ומורכב משרשת הנשימה ו-ATP synthase. תפקיד שרשרת הנשימה ביצירת ATP הוא ליצור מפל פרוטונים בין צידי הממברנה הפנימית של המיטוכונדריה שייצור כוח אלקטרו-מניע (proton-motiveforce). כוח זה מניע את הפרוטונים דרך ATP synthase במורד מפל הריכוזים ומאפשר את הזירחון של ADP ל-ATP. מפל ריכוזים מלאכותי שיוצר שוני בריכוז פרוטונים ומטענים בין צידי הממברנה הפנימית של המיטוכונדריה, גורם ליצירת ATP גם ללא נוכחות של גורם מחמצן (כמו חמצן שדרוש להתרחשות של שרשרת הנשימה כמקבל האלקטרונים האחרון בשרשרת).
כאשר התא בהיפוקסיה (חוסר בחמצן) כמו במצב של התקף לב או שבץ, מעבר אלקטרונים לחמצן מאט וכך גם מעבר הפרוטונים למרווח הבין ממברנלי. כך אין כוח אלקטרו-מניע שדוחף ליצירת ATP. במצב כזה ATP synthase יכול לפעול בצורה הפוכה ולבצע הידרוליזה ל-ATP ותוך כדי לשאוב פרוטונים החוצה לכיוון המרווח הבין ממברנלי (כאשר במצב רגיל הוא שואב פרוטונים לכיוון המטריקס). במקרה כזה ריכוז ATP יכול לרדת לרמות הרסניות לתא. מצב זה נמנע ע”י חלבון קטן IF1 שנקשר לשני ATP synthase בו זמנית ומונע את פעילותם. IF1 פעיל רק בצורת דימר שנוצרת בתנאים של pH נמוך. בתא היפוקסי המקור העיקרי ל-ATP הוא גליקוליזה, כאשר Pyruvate שנוצר בתהליך מומר לחומצה לקטית (Lacticacid), דבר המוריד את ה-pH בתא.
בשאלה הנוכחית המיטוכונדריה מכילות רק את האנזימים המשתתפים בנשימה תאית ולכן אין בהן אתIF1. המיטוכונדריה הללו מודגרות בתמיסה בעלת pH 4, שהוא pH חומצי בעל ריכוז גבוה של פרוטונים. חדירה איטית של התמיסה למטריקס מובילה להשוואת ריכוזים כך שה-pH במטריקס הופך ל-pH 4. בחשיפת המיטוכונדריה לתמיסה חדשה בעלת pH 7, שהוא pH בסיסי בעל ריכוז נמוך של פרוטונים, גורמת לכך שהריכוז של הפרוטונים במטריקס יהיה גבוה מזה שבמרווח הבין ממברנלי (התמיסה במרווח הבין ממברנלי זהה לזו שבציטוזול מבחינת pH בזכות הפורות, pores, שמאפשרים מעבר של חומרים הקטנים מ-5KD). מצב זה דומה למצב של היפוקסיה ולכן ATP synthase צפוי לפעול בצורה הפוכה למצב התקין ולפרק מולקולות ATP במטריקס.
שלילת מסיחים:
ד. יצירת ATP או פירוק שלו מתרחשת ע”י החלק של ATP synthase שמצוי בתוך המטריקס. חלק זה נקרא F1 והוא מורכב מתתי יחידות שקושרות ADP, ATP ו-Pi ומבצעות את הזירחון ליצירת ATP. חלק זה לא משנה את המיקום שלו למרווח הבין ממברנלי ולכן במצב המתואר בשאלה, פירוק של ATP יתרחש במטריקס בלבד.
להרחבה- Lehninger, מהדורה שישית, עמודים 747-748 (גרדיאנט הפרוטונים כגורם העיקרי ליצירת ATP), 752 (מבנה ATP synthase), 760 (ATPsynthase יכול לבצע הידרוליזה לATP).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר אלקטרונים+ סינתזת ATP.
להרחבה- Lehninger, מהדורה שמינית, פרק 19, עמודים 2407-2408 (גרדיאנט הפרוטונים כגורם העיקרי ליצירת ATP
, 2421 (מבנה ATP synthase), 2448-2450 ( (ATPsynthase יכול לבצע הידרוליזה לATP).
ביוכימיה 5 שאלה 29
ואלינומיצין (Valinomycin) מעביר יוני אשלגן מהמרווח הבין ממברנאלי למטריקס המיטוכונדריון. כיצד משפיע ואלינומיצין על מפל הפרוטונים?
במה השאלה עוסקת: זירחון חימצוני- oxidative phosphorylation.
תשובה ב. זירחון חימצוני הוא תהליך יצירת ATP במיטוכונדריה ומורכב משרשת הנשימה ו-ATP synthase. תפקיד שרשרת הנשימה ביצירת ATP הוא ליצור מפל פרוטונים בין צידי הממברנה הפנימית של המיטוכונדריה. בזכות מפל הפרוטונים נוצרת אנרגיה אלקטרוכימית שנקראת proton-motive force (כוח אלקטרו-מניע). אנרגיה זו בעלת שני מרכיבים: מרכיב כימי שנוצר כתוצאה מהפרש בריכוזי הפרוטונים, והמרכיב החשמלי שנוצר כתוצאה מהפרש מטענים כאשר פרוטונים, שהם יונים חיוביים, יוצרים סביבה חיובית יותר במרווח הבין ממברנלי. ATP synthase משתמש בכוח האלקטרו-מניע שנוצר בעקבות מפל הפרוטונים ליצירת ATP. העברת פרוטונים במורד מפל הריכוזים שלהם (מהמרווח הבין ממברנלי לכיוון המטריקס) דוחף את הזירחון של ADP ליצירת ATP.
המעבר של פרוטונים דרך ATP synthase מאזנת את הפרש המטענים והפרש ריכוזי הפרוטונים בין צידי הממברנה ומאפשרת את המשך פעילות שרשרת הנשימה. ללא ATP synthase שרשרת הנשימה הייתה יוצרת גרדיינט פרוטונים גדול. גרדיינט זה היה גורם למעבר של עוד פרוטונים למרווח הבין ממברנלי להיות תלוי אנרגיה גדולה יותר, עד שאנרגיה זו הייתה גדולה מהאנרגיה הנוצרת ממעבר האלקטרונים בין הקומפלקסים בשרשרת הנשימה. כך שרשרת הנשימה הייתה מפסיקה לעבוד.
Valinomycin היא Ionophore (חומר שקושר יונים בצורה הפיכה) הידרופובי שעובר דרך הממברנה הפנימית של המיטוכונדריה, מעביר יוני אשלגן (יונים חיוביים) מהמרווח הבין ממברנלי למטריקס וכך מפר את הפרש המטענים בין צידי הממברנה. Valinomycin מפר את הצימוד הקיים בין שרשרת הנשימה ל-ATP synthase בכך שהוא מבצע את הפעילות של ATP synthase כמאזן של הפרש המטענים. בנוסף, Valinomycin מוריד את המרכיב החשמלי של הכוח האלקטרו מניע וכך אינו חזק מספיק כדי לדחוף את ATP synthase לייצר ATP.
לכן Valinomycin ממקטין את המפל החשמלי וגורם לעצירת סינתזה של ATP.
שלילת מסיחים:
א. Valinomycin מקטינה את המפל החשמלי שנוצר בעקבות מעבר פרוטונים בשרשרת הנשימה למרווח הבין ממברנלי. זאת בזכות העברה של יוני אשלגן (יונים חיוביים) מהמרווח הבין ממברנלי למטריקס. בזכות כך הכוח האלקטרו-מניע קטן במרכיב החשמלי שלו ולכן לא חזק מספיק כדי לדחוף את ATP synthase ליצור ATP. לכן יצירת ATP נעצרת.
ג. Valinomycin מקטינה את המפל החשמלי שנוצר בעקבות מעבר פרוטונים בשרשרת הנשימה למרווח הבין ממברנלי. זאת בזכות העברה של יוני אשלגן (יונים חיוביים) מהמרווח הבין ממברנלי למטריקס. סינתזת ATP אכן נעצרת בזכות הירידה בחוזק של הכוח האלקטרו-מניע (המרכיב החשמלי קטן).
ד. Valinomycin אכן מקטינה את המפל החשמלי שנוצר בעקבות מעבר פרוטונים בשרשרת הנשימה למרווח הבין ממברנלי. היא אינה מאיצה את יצירת ATP מכיוון שהיא מורידה את החוזק של הכוח האלקטרו-מניע במרכיב החשמלי שלו כך שהוא חלש מידי כדי לדחוף את ATP synthase ליצור ATP.
להרחבה- Lehninger, מהדורה שישית, עמודים 418, 749 (Valinomycin), 743-744 (האנרגיה של שרשרת מעבר האלקטרונים), 748(חקר הצימוד בין שרשרת הנשימה ל-ATP synthase), טבלה בעמוד מספר 739 (פירוט חומרים מעכבים).
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: שרשרת מעבר אלקטרונים+ סינתזת ATP.
להרחבה- Lehninger, מהדורה שמינית, פרק 19,
2398-2401 (האנרגיה של שרשרת מעבר האלקטרונים), 2407-2409(חקר הצימוד בין שרשרת הנשימה ל-ATP synthase), טבלה בעמוד מספר 2382 (פירוט חומרים מעכבים).
ביוכימיה 5 שאלה 30
במצב רעב, תחת השפעת גלוקגון, מתרחשת ליפוליזה ברקמת שומן ובתהליך משתחרר גליצרול וחומצות שומן חופשיות. מה יהיה גורל הגליצרול וחומצות השומן בכבד?
במה השאלה עוסקת: אינטגרציה
תשובה ג. שני הורמונים מרכזיים שמשפיעים בכבד הינם אינסולין וגלוקגון. אינסולין מופרש במצבי שובע ומעודד תהליכי בנייה (אנבוליזם), בעוד גלוקגון מופרש במצבי צום ומעודד תהליכי פירוק (קטבוליזם). במצבי צום הכבד מסנתז גלוקוז (בתהליך הגלוקונאוגנזה) ומפריש אותו לזרם הדם על מנת לספק רקמות אשר תלויות בגלוקוז באופן עיקרי לצורך הפקת אנרגיה – מוח וכדוריות דם אדומות. הגלוקגון בכבד מאקטב את תהליך הגלוקונאוגנזה, בו נוצר הגלוקוז. בין חומרי המוצא לתהליך הגלוקונאוגנזה קיים הגליצרול אשר עובר זרחון ואיזומריזציה לתוצר הביניים דיהידרוקסיאצטון פוספט (DHAP).DHAP לאחר מכן ממשיך את הריאקציות הנותרות של הגלוקונאוגנזה עד שמתקבל גלוקוז. תהליך הגלוקונאוגנזה הינו תהליך אנבולי הצורך 6 מולקולות ATP עבור כל מולקולת גלוקוז שנוצרת. מולקולות ה-ATP המשמשות לתהליך הגלוקונאוגנזה מתקבלות בתהליך חמצון חומצות שומן.
שלילת מסיחים:
א. גופי קטון נוצרים במהלך צום אך הם נוצרים מאצטיל-CoA ולא מגליצרול. בנוסף, במהלך צום קיים יותר פירוק של טריגליצרידים לחומצות שומן ופחות הפיכה של חומצות שומן לטריגליצרידים.
ב. גליצרול אמנם ישמש לתהליך הגלוקונאוגנזה אך סינתזת גופי קטון איננה דורשת ATP.
ד. כאשר גליצרול הופך לDHAP הוא יכול לפנות בכבד לתהליך הגליקוליזה או הגלוקונאוגנזה כתלות בתנאים. במצבי צום, הגליצרול יפנה לתהליך הגלוקונאוגנזה ולא גליקוליזה. בנוסף, חומצות שומן אכן מתפרקות לאצטיל-CoA אך הוא איננו הופך לגלוקוז ביונקים.
להרחבה – Lehninger, מהדורה שישית, עמוד 669 (HormonesTriger Mobilization of Triacylglycerols)
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: קטבוליזם של חומצות שומן+ גופי קטון.
להרחבה – Lehninger, מהדורה שמינית, פרק 17, עמוד 2186 (HormonesTriger Mobilization of Triacylglycerols)
ביוכימיה 5 שאלה 31
ריאקציות חימצון-חיזור ביולוגיות מערבות את כל הבאים, למעט:
במה השאלה עוסקת: ריאקציות חמצון חיזור
תשובה ב. ריאקציית חמצון-חיזור מערבת מעבר של אלקטרונים מחומר מוסר אלקטרונים (= מחזר, donor) שעובר חמצון לחומר מקבל אלקטרונים (= מחמצן, acceptor) שעובר חיזור. ריאקציות אלו לרוב מבוצעות ע”י אנזימים ממשפחת הדהידרוגנאזות (dehydrogenases).
מעבר האלקטרונים לחומר המקבל יכול להתבצע במספר דרכים: מעבר ישיר, מעבר של אטום מימן (פרוטון אחד ואלקטרון אחד), מעבר של יון הידריד (שני אלקטרונים ופרוטון אחד) או שילוב של מולקולת חמצן בתוצר. כאשר מתרחש מעבר של יון הידריד למעשה אנזים דהידרוגנאז “לוקח” מהסובסטרט 2 אטומי מימן, יון ההידריד עובר לחומר המיועד לחיזור והפרוטון הנותר משתחרר לסביבה המימית. פרוטון לבדו אינו יציב בסביבה מימית ולכן ישר מתחבר עם מולקולת מים אחרת בסביבה ליצירת יון הידרוניום.
יצירה של אלקטרונים חופשיים (רדיקלים חופשיים) מתרחשת בעיקר במיטוכונדריה כתוצר לוואי של תהליך הנשימה התאית ובגופנו נמצאים אנזימים נוגדי חמצון שתפקידם לווסת את ריכוזי הרדיקלים החופשיים ולמנוע את פגיעתם בגוף, שכן במצב של חוסר איזון הם יפגעו בעיקר במולקולות מחוזרות בתא כמו השומנים המרכיבים את הממברנות.
הרחבה – פוטנציאל החיזור של החומר מתאר את נטייתו לקבל אלקטרונים ונמדד ביחידות של וולט (volt). ריאקציית חמצון-חיזור תתרחש באופן ספונטני לכיוון בו החומר בעל פוטנציאל החיזור הגבוה יותר מקבל את האלקטרונים כך שלמעשה ניתן לומר כי תנועת האלקטרונים בעולם הביולוגי היא מחומר בעל פוטנציאל חיזור נמוך לגבוה, ΔE חיובי ו- ΔG שלילי (ריאקציה אקסרוגנית) לפי הנוסחא ΔG = -nFΔE .(כש n = מס’ האלקטרונים שעוברים).
להרחבה – Lehninger,מהדורה שישית, עמודים 528-534.
נושא: ביוכימיה. תת נושא: מטבוליזם חלק ב- זרחון חמצוני, פירוק חומצות שומן. תת תת נושא: תגובות חמצון חיזור בביולוגיה.
להרחבה – Lehninger, מהדורה שמינית, פרק 13, עמודים 1787-1798.
